Scopri i nostri ultimi Quiz
Si definiscono isomeri, composti ...

Opzioni di Risposta

con diversa formula molecolare ma stessa disposizione nello spazio

che hanno la stessa formula molecolare e diversa disposizione nello spazio

che appartengono alla stessa serie omologa

che hanno gli stessi punti di fusione

che non appartengono alla stessa serie omologa
Si definiscono isomeri composti che hanno la stessa formula molecolare e diversa disposizione nello spazio. Questa definizione � corretta perch� gli isomeri sono molecole che condividono la stessa formula chimica ma differiscono nella disposizione degli atomi nello spazio, il che porta a diverse propriet� chimiche e fisiche. Gli isomeri si dividono principalmente in due categorie: isomeri strutturali e stereoisomeri. Gli isomeri strutturali differiscono nel modo in cui gli atomi sono collegati tra loro, mentre gli stereoisomeri hanno la stessa connettivit� atomica ma differiscono nell'orientamento spaziale degli atomi. Un esempio comune di stereoisomeria � la configurazione cis-trans nei doppi legami o la chiralit� nei centri asimmetrici. Questa capacit� di formare isomeri � fondamentale in chimica organica e biochimica, poich� anche piccole variazioni nella struttura possono portare a differenze significative nelle propriet� di un composto.
L'ossidazione totale di una molecola di metano dà origine a:

Opzioni di Risposta

una mole di CO2

una mole di CO2 e due moli di H2O

due moli di CO2

due moli di CO2 e due moli di H2O

una mole di CO ed una mole di CO2
L'ossidazione totale di una molecola di metano d� origine a una mole di CO? e due moli di H?O. Quando il metano (CH?) viene completamente ossidato, reagisce con l'ossigeno (O?) in una reazione di combustione. L'equazione bilanciata per questa reazione � CH? + 2O? ? CO? + 2H?O. In questa reazione, una mole di metano reagisce con due moli di ossigeno per produrre una mole di anidride carbonica (CO?) e due moli di acqua (H?O). La combustione del metano � un processo esotermico che rilascia energia sotto forma di calore, ed � un esempio di reazione di ossidazione in cui il carbonio del metano viene ossidato da uno stato di ossidazione di -4 a +4 nella CO?, mentre l'idrogeno viene ossidato da 0 a +1 nell'acqua. Questo bilanciamento di massa e carica conferma la correttezza della risposta fornita.
Calcolare la quantità di ammoniaca (17 u.m.a.) contenuta in 500 ml di una soluzione acquosa 0,02 M.

Opzioni di Risposta

0,34 g

0,17 g

0,17 mg

0,085 g

0,34 mg
La domanda chiede di calcolare la quantit� di ammoniaca contenuta in 500 ml di una soluzione acquosa 0,02 M, e la risposta corretta � 0,17 g. Per determinare la massa di ammoniaca in questa soluzione, bisogna prima calcolare il numero di moli di ammoniaca presenti. La molarit� (M) � definita come il numero di moli di soluto per litro di soluzione. Dato che la soluzione � 0,02 M, in 1 litro ci sono 0,02 moli di ammoniaca. Considerando che abbiamo 500 ml, ovvero 0,5 litri, il numero di moli di ammoniaca sar� 0,02 mol/L � 0,5 L = 0,01 moli. La massa di una mole di ammoniaca � data dal suo peso molecolare, che � 17 g/mol. Pertanto, la massa di 0,01 moli di ammoniaca sar� 0,01 mol � 17 g/mol = 0,17 g. Questo calcolo conferma che la quantit� di ammoniaca presente nella soluzione � effettivamente 0,17 g.
Qual è la concentrazione, espressa in moli dm-3, di una soluzione ottenuta sciogliendo 2,0 g di idrossido di sodio in 25,0 cm3 d'acqua? [masse atomiche relative: Na = 23; O = 16; H = 1]

Opzioni di Risposta

0,50 mol dm-3

2,00 mol dm-3

1,00 mol dm-3

0,25 mol dm-3

2,50 mol dm-3
La concentrazione, espressa in moli dm?�, di una soluzione ottenuta sciogliendo 2,0 g di idrossido di sodio in 25,0 cm� d'acqua � 2,00 mol dm?�. Per determinare la concentrazione, dobbiamo prima calcolare il numero di moli di idrossido di sodio (NaOH). La massa molare di NaOH si calcola sommando le masse atomiche relative: Na (23), O (16) e H (1), ottenendo 40 g/mol. Dividendo la massa di NaOH (2,0 g) per la massa molare (40 g/mol), otteniamo 0,05 mol. La concentrazione molare si calcola dividendo il numero di moli per il volume della soluzione in dm�. Convertendo 25,0 cm� in dm� otteniamo 0,025 dm�. Infine, dividendo 0,05 mol per 0,025 dm�, otteniamo una concentrazione di 2,00 mol dm?�, confermando che la risposta � corretta.
Quante delle seguenti reazioni sono solo ossidazioni (Ox), quante solo riduzioni (Red), quante ossidoriduzioni (Redox)?
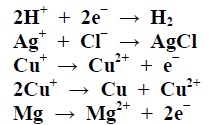
Opzioni di Risposta

Ox: 2 Red: 2 Redox: 1

Ox: 1 Red: 1 Redox: 2

Ox: 2 Red: 1 Redox: 1

Ox: 1 Red: 2 Redox: 1

Ox: 2 Red: 1 Redox: 2
La domanda chiede quante delle reazioni elencate sono solo ossidazioni, quante solo riduzioni e quante ossidoriduzioni, con la risposta corretta che �: Ox: 2, Red: 1, Redox: 1. Per determinare il tipo di reazione, � necessario considerare i cambiamenti nel numero di ossidazione degli elementi coinvolti. Una reazione di ossidazione comporta un aumento del numero di ossidazione di una sostanza, mentre una riduzione comporta una diminuzione. Nel caso delle reazioni ossidoriduttive, o redox, entrambi i processi di ossidazione e riduzione avvengono simultaneamente. Analizzando le reazioni fornite, due di esse mostrano un aumento del numero di ossidazione senza alcuna riduzione, classificandole come ossidazioni. Una reazione mostra una diminuzione del numero di ossidazione senza alcuna ossidazione, rendendola una riduzione. Infine, una reazione mostra un elemento che si ossida e un altro che si riduce, classificandola correttamente come una reazione redox. Questo tipo di analisi permette di identificare correttamente il numero di ciascun tipo di reazione.
Nella tabella sottostante sono riportati i valori delle prime otto energie di ionizzazione di un elemento il cui numero atomico è minore di 20. A quale Gruppo della Tavola Periodica appartiene l'elemento?

Opzioni di Risposta

Gruppo 15

Gruppo 1

Gruppo 2

Gruppo 13

Gruppo 14
Nella domanda viene chiesto a quale Gruppo della Tavola Periodica appartiene un elemento con numero atomico minore di 20, in base alle sue prime otto energie di ionizzazione, e la risposta corretta �: "Gruppo 13". Le energie di ionizzazione sono le energie richieste per rimuovere successivamente gli elettroni da un atomo in fase gassosa. Gli elementi del Gruppo 13, come il boro e l'alluminio, mostrano un aumento significativo tra la terza e la quarta energia di ionizzazione. Questo � dovuto al fatto che, dopo la rimozione dei primi tre elettroni, si inizia a rimuovere un elettrone da un guscio elettronico pi� interno e pi� stabile, causando un aumento pi� marcato dell'energia necessaria. Se l'elemento in esame mostra un simile andamento tra la terza e la quarta energia di ionizzazione, � probabile che appartenga al Gruppo 13, in quanto la configurazione elettronica dei suoi elettroni di valenza termina con tre elettroni nel guscio pi� esterno.
I composti con formula CnH2N :

Opzioni di Risposta

Sono sicuramente alchini

Sono sicuramente cicloalcani

Possono essere cicloalcani o alcheni

Sono sicuramente alcheni

Possono essere cicloalcheni o alchini
La domanda chiede quali composti possono avere la formula C?H?? e la risposta corretta � che possono essere cicloalcani o alcheni. La formula C?H?? � caratteristica dei composti insaturi con un grado di insaturazione, che pu� derivare dalla presenza di un doppio legame carbonio-carbonio, come negli alcheni, o da un anello, come nei cicloalcani. Nei cicloalcani, la chiusura dell'anello riduce il numero di atomi di idrogeno rispetto agli alcani lineari saturi, che hanno la formula generale C?H????. Negli alcheni, il doppio legame riduce anch'esso il numero totale di atomi di idrogeno, rispetto agli alcani, di due unit�. In entrambi i casi, la somma degli atomi di carbonio e idrogeno soddisfa la formula C?H??, rendendo quindi possibile che tali composti siano o cicloalcani o alcheni.
Il valore calorico dei seguenti componenti, espresso in Kcal/100 mg, e': (vedi foto). Un campione del formaggio A contiene 14,50 g di proteine, 11,12 g di lipidi e 5,50 g di glicidi. Il numero totale di Kcal del campione e':
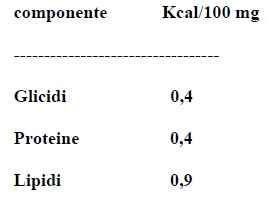
Opzioni di Risposta

180

195

175

190

176
Il valore calorico dei seguenti componenti, espresso in Kcal/100 mg, e': (vedi foto). Un campione del formaggio A contiene 14,50 g di proteine, 11,12 g di lipidi e 5,50 g di glicidi. Il numero totale di Kcal del campione e': 180. Per calcolare il numero totale di Kcal nel campione di formaggio, � necessario conoscere il valore calorico per grammo di ciascun macronutriente: le proteine e i glicidi forniscono circa 4 Kcal/g, mentre i lipidi forniscono circa 9 Kcal/g. Applicando questi valori, il calcolo � il seguente: le proteine forniscono 14,50 g x 4 Kcal/g = 58 Kcal, i lipidi forniscono 11,12 g x 9 Kcal/g = 100,08 Kcal e i glicidi forniscono 5,50 g x 4 Kcal/g = 22 Kcal. Sommando questi contributi calorici, si ottiene un totale di 180,08 Kcal, che arrotondato al numero intero pi� vicino � 180 Kcal, confermando cos� che la risposta corretta � 180.
A una soluzione acquosa acida di KBrO3 (100 mL, 0,1 mol/L) vengono aggiunti 100 mL di una soluzione acquosa contenente 0,006 moli di K2S2O3 e 0,09 moli di KI. Avvengono le seguenti reazioni quantitative: (vedi foto). La reazione (2) è istantanea, mentre la reazione (1) è relativamente lenta. Nel momento in cui tutto l’anione S2O32− presente in soluzione avrà reagito, quante moli di BrO3- saranno state consumate?
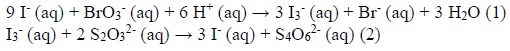
Opzioni di Risposta

0,002 mol.

0,003 mol.

0,036 mol.

0,001 mol.

0,009 mol.
In una soluzione acquosa acida, quando 100 mL di KBrO? (0,1 mol/L) vengono mescolati con 100 mL di una soluzione contenente 0,006 moli di K?S?O? e 0,09 moli di KI, sono consumate 0,001 moli di BrO??. La spiegazione risiede nel fatto che la reazione (1) tra BrO?? e I? � lenta e produce I?, mentre la reazione (2) tra I? e S?O?�? � istantanea. Quando tutto l�anione S?O?�? � stato consumato, significa che ha reagito con l�I? prodotto fino a quel momento. Poich� la stechiometria della reazione (2) � tale che 1 mol di I? reagisce con 2 mol di S?O?�?, 0,006 moli di S?O?�? possono reagire con 0,003 moli di I?. La reazione (1) ha una stechiometria di 1:3 tra BrO?? e I?, quindi per produrre 0,003 moli di I? sono necessarie 0,001 moli di BrO??, spiegando cos� il consumo di 0,001 moli di BrO??.
Il diagramma in figura rappresenta la variazione di energia potenziale in una generica reazione A +B ↔ C+D. In base ad esso indicare l’affermazione corretta.
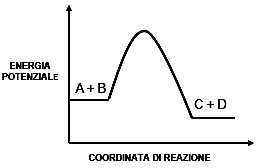
Opzioni di Risposta

L’energia potenziale dei reagenti e dei prodotti è la stessa.

L’energia di attivazione è uguale per la reazione diretta e per la reazione inversa.

Il diagramma rappresenta una reazione il cui meccanismo prevede un unico stadio in entrambi i sensi.

Lo stato di transizione coincide con la stabilizzazione del complesso attivato.

La reazione diretta è catalizzata, mentre la reazione inversa non lo è.
Il diagramma in figura rappresenta la variazione di energia potenziale in una generica reazione A + B ? C + D. In base ad esso indicare l�affermazione corretta. Il diagramma rappresenta una reazione il cui meccanismo prevede un unico stadio in entrambi i sensi. La rappresentazione grafica dell'energia potenziale mostra un unico picco tra i reagenti (A + B) e i prodotti (C + D), suggerendo che la reazione avviene attraverso un singolo stato di transizione. Questo implica che non ci sono intermedi stabili lungo il percorso di reazione, caratteristica tipica delle reazioni a singolo stadio. In una reazione a pi� stadi, ci sarebbero pi� picchi e valli nel diagramma, corrispondenti agli stati di transizione e agli intermedi. La simmetria del diagramma in entrambi i sensi indica che il meccanismo � lo stesso sia per la reazione diretta che per quella inversa, confermando che il processo avviene in un unico stadio in entrambe le direzioni.
Piano di Studio con AI
Lezioni Online