Reazioni che coinvolgono di alcoli
Definizione
Come discusso per gli alcheni, le reazioni di addizione al doppio legame costituiscono una via privilegiata per ottenere alcoli. L’addizione di acqua a un alchene in presenza di un catalizzatore acido (idratazione acido-catalizzata) genera un carbocatione intermedio e segue la regola di Markovnikov: il protone si aggiunge all’atomo di carbonio più ricco di idrogeni, mentre il gruppo –OH si lega al carbonio più sostituito. Ne risulta il prodotto derivante dal carbocatione più stabilizzato. In forma schematica:
\[\mathrm{R{-}CH{=}CH_2} \xrightarrow[\text{H_2O}]{\text{H}^+} \mathrm{R{-}CH(OH){-}CH_3}\]
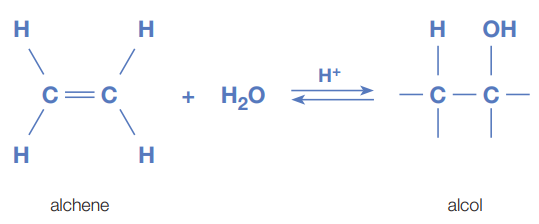 |
| Idratazione degli alcheni |
L’idratazione acido-catalizzata è sensibile a riarrangiamenti del carbocatione (migrazioni idridiche o alchiliche) qualora consentano intermedi più stabili; in sintesi preparative si impiegano spesso varianti che evitano tali riarrangiamenti o modificano la regioselettività, come l’ossimercurazione-demercurazione (Markovnikov senza riarrangiamenti) e l’idroborazione-ossidazione, che fornisce alcoli con orientamento anti-Markovnikov e addizione sin.
Gli alcoli si ottengono inoltre per riduzione di gruppi carbonilici. Aldeidi e chetoni sono convertiti selettivamente nei corrispondenti alcoli mediante idrogenazione catalitica oppure con reagenti idruro. Le aldeidi forniscono alcoli primari, i chetoni alcoli secondari:
 |
| Dall’aldeide si ottiene l’alcol primario |
 |
| Mentre dai chetoni si ottengono gli alcol secondari |
Nella pratica di laboratorio si impiegano frequentemente boro-idruro di sodio (NaBH4, selettivo e compatibile con solventi protici) e alluminio-idruro di litio (LiAlH4, più reattivo e usato in solventi aprotici eterei). L’idrogenazione catalitica (H2/Ni, Pd o Pt) rappresenta un’alternativa scalabile, particolarmente utile su substrati attivati o in presenza di sistemi insaturi da ridurre contestualmente.
Il riscaldamento di un alcol con acido solforico o fosforico concentrati promuove la disidratazione, un’eliminazione di H2O che trasforma l’alcol in alchene. In termini formali, si rimuovono un protone in β e il gruppo ossidrilico in α (rispetto al carbonio carbinoico), generando un doppio legame:
\[\mathrm{R{-}CH_2{-}CH_2OH} \xrightarrow[\Delta]{\mathrm{H}^+} \mathrm{R{-}CH{=}CH_2} + \mathrm{H_2O}\]
 |
| Formazione di alcheni. Gli alcheni si possono preparare per disidratazione di un alcol in ambiente acido con somministrazione di calore. |
Per alcoli secondari e terziari, la disidratazione procede tipicamente via meccanismo E1 con formazione di un carbocatione, e l’orientamento segue la regola di Zaitsev (l’alchene più sostituito è favorito). Con alcoli primari, l’eliminazione può avvenire per via concertata E2. Riarrangiamenti cationici sono possibili quando portano a prodotti più stabili, con conseguente miscela di isomeri alchenici.
Esempi tipici:
Esempio 1 – Etanolo → etene
\[\mathrm{CH_3CH_2OH} \xrightarrow[\Delta]{\mathrm{H}^+} \mathrm{CH_2{=}CH_2} + \mathrm{H_2O}\]
Esempio 2 – 1-propanolo → propene
\[\mathrm{CH_3CH_2CH_2OH} \xrightarrow[\Delta]{\mathrm{H}^+} \mathrm{CH_3CH{=}CH_2} + \mathrm{H_2O}\]
In termini operativi:
- il substrato è un alcol alifatico o alilico/benzilico suscettibile di protonazione dell’ossidrile;
- in ambiente acido e a temperatura elevata (Δ) si elimina una molecola d’acqua, con possibile competizione tra E1 ed E2 in funzione della struttura dell’alcol e delle condizioni;
- il/i prodotto/i sono alcheni, con distribuzione regolata da stabilità dell’alchene (Zaitsev) e da eventuali riarrangiamenti del carbocatione.
Quando sono possibili più alcheni costituzionali o geometrici, si osservano spesso miscele. Un caso illustrativo è la disidratazione del 2-metil-2-butanolo, che porta sia a 2-metil-1-butene sia a 2-metil-2-butene:
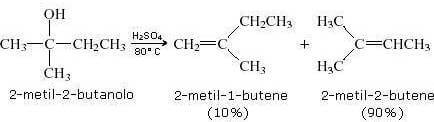 |
| Reazione del 2-metil-2-butanolo a date 2-metil-1-butene e 2-metil-2-butene. |
Processi biologici impiegano eliminazioni d’acqua catalizzate da enzimi. Nella glicolisi, l’enolasi catalizza la conversione del 2-fosfoglicerato in fosfoenolpiruvato, rimuovendo H2O e generando un enolo attivato ad alta energia di legame fosfoanidridico:
| Esempio di trasformazione chimica con Enolasi come catalizzatore. |
Gli alcoli subiscono ossidazione a composti carbonilici o acidi carbossilici mediante diversi ossidanti. Per brevità si indica con [O] un agente ossidante generico; esempi classici sono permanganato di potassio in ambiente basico (KMnO4/OH−) e acido cromico (H2CrO4). Si adottano inoltre ossidanti selettivi anidri, quali PCC/PDC o il periodinano di Dess–Martin, utili per fermarsi allo stadio aldeidico.
In condizioni forti, un alcol primario è ossidato prima ad aldeide e poi ad acido carbossilico; un alcol secondario fornisce un chetone; gli alcoli terziari sono generalmente inerti poiché il carbonio carbinoico non possiede un legame C–H necessario alla formazione del carbonile:
\[ \begin{aligned} \mathrm{R{-}CH_2OH} &\xrightarrow{[O]} \mathrm{R{-}CHO} \xrightarrow{[O]} \mathrm{R{-}COOH},\\ \mathrm{R_2CHOH} &\xrightarrow{[O]} \mathrm{R_2C{=}O},\\ \mathrm{R_3COH} &\xrightarrow{[O]} \text{nessuna reazione (assenza di H sul carbonio carbinoico).} \end{aligned} \]
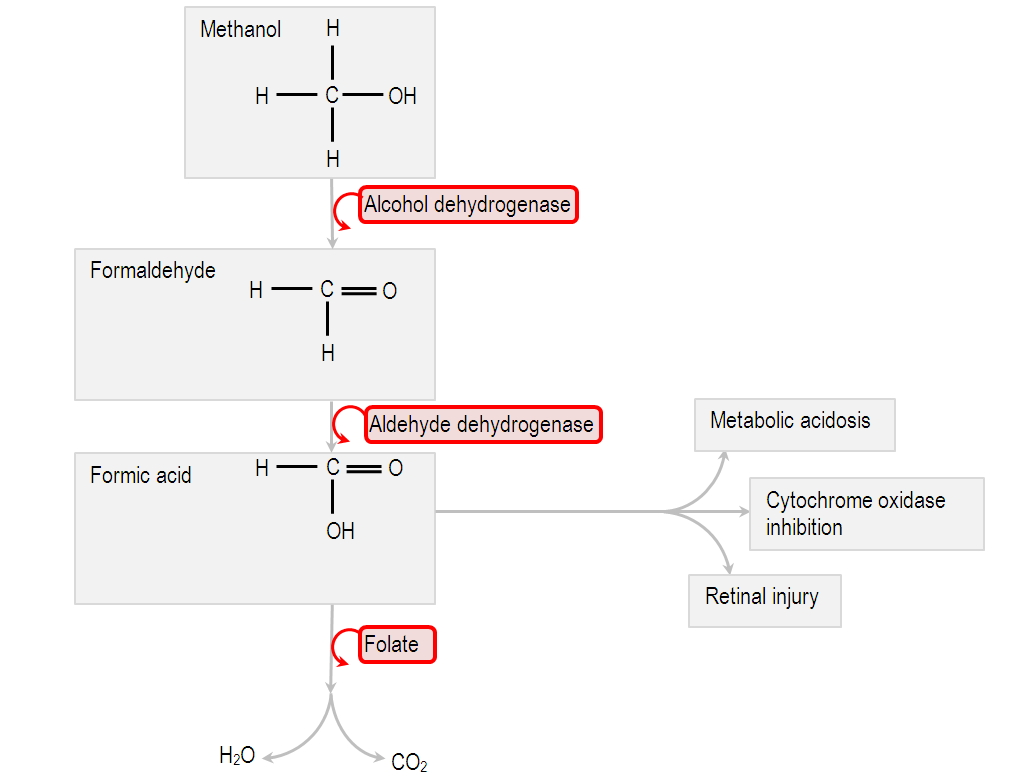 |
| Nei mammiferi, il metanolo (1) viene ossidato per via enzimatica (alcol deidrogenasi) a formaldeide (2); quest'ultima viene quindi ossidata ulteriormente, sempre tramite enzimi (aldeide deidrogenasi), ad acido formico (3), il quale viene espulso tramite le urine sotto forma di formiato. In alternativa, l'acido formico (3) può essere mineralizzato a CO2 ed eliminato attraverso i polmoni. L'elevata tossicità del metanolo, soprattutto se confrontata con quella dell'etanolo, è legata alla formazione dell'intermedio formaldeide (2), che è altamente reattivo; questa molecola, inoltre, viene metabolizzata dagli enzimi molto più lentamente dell'acetaldeide. |
La progressione ossidativa degli alcoli primari attraverso lo stadio aldeidico fino all’acido, spesso via idrati dell’aldeide in ambiente acquoso, è illustrata di seguito:
 |
| Fasi dell'ossidazione degli alcoli primari ad acidi carbossilici tramite aldeidi e idrati di aldeidi. |
L’esito può essere riassunto come segue: l’ossidazione di un alcol primario genera un’aldeide e, con ossidanti potenti o condizioni prolungate, l’acido corrispondente; l’ossidazione di un alcol secondario porta a un chetone; gli alcoli terziari non sono ossidabili in condizioni ordinarie per assenza di un idrogeno sul carbonio portatore dell’ossidrile, requisito necessario per la trasformazione in gruppo carbonilico.
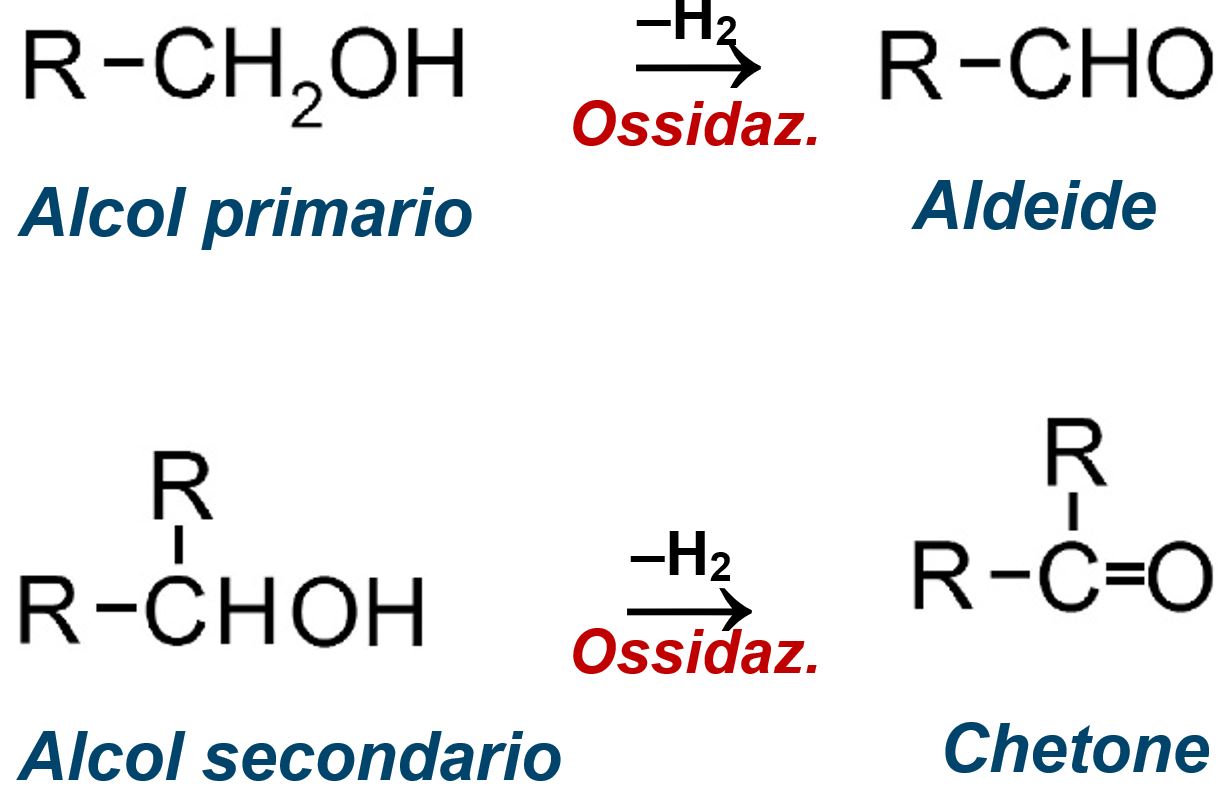 |
| Ossidazione di un Alcol primario o secondario con produzione di Aldeide o Chetone. |
Nel metabolismo umano, l’etanolo è ossidato nel fegato ad etanale (acetaldeide) per azione dell’alcol deidrogenasi, quindi ad acido etanoico per opera dell’aldeide deidrogenasi; l’acetato è poi convertito a CO2 e H2O con rilascio di energia. Un eccesso di etanolo determina accumulo di acetaldeide, responsabile di effetti sistemici spiacevoli.
| Tra tutte le trasformazioni effettuate dai batteri dell’acido acetico, quella che ha più interesse enologico è la trasformazione dell'etanolo in acido acetico. Gli Acetobacter sono anche in grado di ossidare l'acido acetico, ma questa reazione è inibita dall'etanolo. In condizioni di aerobiosi il 75% dell’acetaldeide porta a la formazione di acido acetico e in condizione di molta aereazione tutto l'etanolo si converte in acido acetico. Quando l’ambiente si impoverisce di ossigeno, l'acetaldeide si accumula nel mezzo. È una reazione pH-dipendente, in un ambiente acido sia ha l'ossidazione e l’accumulo di acetaldeide piuttosto che la trasformazione ad acido acetico. |
In ambito microbiologico, specie del genere Acetobacter ossidano l’etanolo ad acido acetico in condizioni aerobiche; tale processo, rilevante per l’enologia, è modulato dalla disponibilità di ossigeno e dal pH, che influenzano l’equilibrio tra accumulo di acetaldeide e ulteriore ossidazione ad acetato.








