Le equazioni chimiche rappresentano trasformazioni chimiche
Definizione
In un’equazione di reazione, i coefficienti interi posti davanti alle formule chimiche (coefficienti stechiometrici) indicano i rapporti molari tra reagenti e prodotti. Tali coefficienti moltiplicano l’intera formula, quindi tutti gli atomi che la compongono. Per esempio, 2NaCl rappresenta 2 mol di cloruro di sodio, cioè 2 mol di Na e 2 mol di Cl; analogamente, 3NH\(_3\) corrisponde a 3 mol di molecole di ammoniaca, contenenti complessivamente 3 mol di atomi di N e 9 mol di atomi di H. Il coefficiente 1 è sottinteso: scrivere H\(_2\)SO\(_4\) equivale a 1 mol di acido solforico, contenente 2 mol di H, 1 mol di S e 4 mol di O.
È essenziale distinguere tra coefficienti (che si possono modificare per bilanciare) e pedici nelle formule chimiche (che definiscono l’identità della sostanza e non si devono cambiare). La legge di conservazione della massa richiede che il numero totale di atomi di ciascun elemento sia identico nei due membri dell’equazione.
Esempio di equazione già in forma bilanciata
Consideriamo la decomposizione del clorato di potassio:
\[ \text{2 KClO}_{3}(s) \;\xrightarrow{\Delta}\; \text{2 KCl}(s) + \text{3 O}_{2}(g) \]
Conteggio degli atomi nel membro dei reagenti:
- K: 2 mol;
- Cl: 2 mol;
- O: 6 mol.
Conteggio degli atomi nel membro dei prodotti:
- K: 2 mol;
- Cl: 2 mol;
- O: 6 mol.
I bilanci sono equivalenti per ogni elemento, pertanto l’equazione soddisfa la conservazione della massa e risulta già bilanciata.
Esempio di bilanciamento e errore tipico da evitare
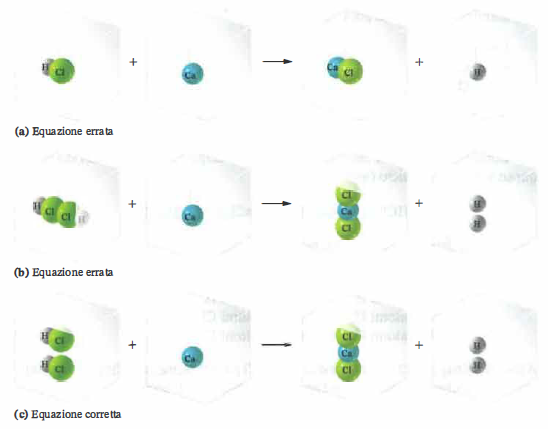
Si esamini la reazione in soluzione acquosa tra zinco metallico e acido cloridrico:
\(\ce{HCl(aq) + Zn(s) -> ZnCl2(aq) + H2(g)}\).
Scritta in questo modo, l’equazione non è bilanciata: il cloro e l’idrogeno risultano in difetto nel membro dei reagenti. Un tentativo scorretto consisterebbe nel modificare i pedici:
\(\ce{H2Cl2(aq) + Zn(s) -> ZnCl2(aq) + H2(g)}\).
Anche se il conteggio atomico sembrerebbe tornare, questa forma è inammissibile perché altera l’identità chimica dell’acido, che è HCl e non H\(_2\)Cl\(_2\). Il bilanciamento deve avvenire unicamente introducendo coefficienti interi, senza modificare le formule delle specie coinvolte. L’equazione corretta è:
\(\ce{2 HCl(aq) + Zn(s) -> ZnCl2(aq) + H2(g)}\).
Il procedimento è illustrato in (Figura 04.04-01).
Procedura sistematica per il bilanciamento
Acquisite l’identità delle specie, lo stato fisico e le condizioni di reazione, l’equazione può essere bilanciata per ispezione seguendo una sequenza logica:
- 1° fase: contare gli atomi di ciascun elemento nei reagenti e nei prodotti, indicando chiaramente il totale per ogni lato;
- 2° fase: identificare gli elementi sbilanciati e stabilire un ordine di intervento, preferendo per primi quelli che compaiono in meno composti;
- 3° fase: introdurre coefficienti stechiometrici per bilanciare un elemento alla volta, evitando di cambiare i pedici nelle formule; se utile, considerare come unità i gruppi poliatomici che restano intatti sui due lati;
- 4° fase: verificare il risultato ripetendo il conteggio atomico; in caso di coefficienti frazionari, moltiplicare tutti i coefficienti per il minimo comune multiplo per ottenere interi; ridurre infine alla minima proporzione intera possibile.
Accorgimenti pratici:
- Lasciare spesso H e O per ultimi, a meno che non compaiano in una sola specie;
- Controllare la coerenza delle unità di fase (s, l, g, aq) per mantenere la congruità fisico-chimica;
- Per equazioni in forma ionica, assicurare sia il bilancio di massa sia il bilancio di carica complessiva;
- Usare coefficienti più piccoli possibili, mantenendo rapporti interi.
Molti processi chimici di base possono essere organizzati in alcune classi ricorrenti, accomunate dal tipo di trasformazione che avviene tra i reagenti. In particolare, risultano centrali:
- l’unione di specie ioniche in soluzione con formazione di un solido poco solubile, cioè un precipitato;
- le trasformazioni in presenza di ossigeno molecolare, che includono ossidazioni rapide (combustioni) e lente (corrosioni);
- i trasferimenti di protoni, H+, tra un acido e una base secondo il modello di Brønsted–Lowry;
- gli scambi di elettroni tra reagenti, noti come reazioni di ossido–riduzione.
Reazioni con formazione di precipitato
Per reazione di precipitazione si intende qualsiasi trasformazione in soluzione dalla quale risultano uno o più prodotti solidi a bassa solubilità nel solvente impiegato, spesso acqua. Quando la concentrazione degli ioni che formano un composto supera il prodotto di solubilità, si ha la nucleazione e crescita del solido. Fenomeni naturali e applicazioni tecnologiche traggono spiegazione da questi processi: la deposizione di carbonati nelle grotte che origina stalattiti e stalagmiti, la precipitazione di ossalato di calcio nei calcoli renali, oppure l’incrostazione di carbonato di calcio nelle caldaie domestiche.
La previsione dell’insorgere di un precipitato, in condizioni usuali, si basa su regole sperimentali di solubilità riassunte in tabelle dedicate: la (Tabella 04.04-01) permette, per esempio, di prevedere se la combinazione di due elettroliti porta o meno alla formazione di un solido. In pratica di laboratorio e di processo, la corretta scelta dei soluti è essenziale per evitare precipitazioni indesiderate.
Come esempio didatticamente equivalente, la mescolanza di soluzioni acquose di cloruro di bario e solfato di sodio produce solfato di bario, sale scarsamente solubile:
\[ \text{BaCl}_2(aq) + \text{Na}_2\text{SO}_4(aq) \longrightarrow \text{BaSO}_4(s) + 2\,\text{NaCl}(aq) \]
La formazione del solido BaSO4(s) è l’evidenza macroscopica della precipitazione.
Processi di combustione e ossidazione con O2
L’ossigeno molecolare reagisce con numerose sostanze, generando in genere calore e, nelle combustioni, talora fiamma. I combustibili organici liberano energia utile nei motori e nelle caldaie; la combustione completa di un idrocarburo conduce tipicamente a anidride carbonica e acqua. Per il propano si ha:
\[ \text{C}_3\text{H}_8(g) + 5\,\text{O}_2(g) \longrightarrow 3\,\text{CO}_2(g) + 4\,\text{H}_2\text{O}(g) \]
L’energia termica rilasciata è il “prodotto” tecnologicamente più rilevante; tra i prodotti di reazione, la CO2 contribuisce all’effetto serra su scala globale.
Molti solidi inorganici vanno incontro a ossidazioni lente. Un esempio comune è l’annerimento del rame esposto all’aria, dovuto alla formazione di ossido rame(II):
\[ 2\,\text{Cu}(s) + \text{O}_2(g) \longrightarrow 2\,\text{CuO}(s) \]
Analogamente, la corrosione del ferro in ambiente umido origina ossidi e idrossidi idrati (genericamente indicati come “ruggine”), mediante processi elettrochimici complessi e lenti.
Trasferimenti acido–base di H+
Secondo la definizione di Brønsted–Lowry, un acido è un donatore di H+, mentre una base è un accettore di H+. In soluzione acquosa, molte reazioni acido–base forti conducono alla formazione di acqua e di un sale completamente dissociato. Un esempio, alternativo al classico HCl/NaOH, è la neutralizzazione tra acido nitrico e idrossido di potassio:
\[ \underset{\text{Acido}}{\text{HNO}_3(aq)} + \underset{\text{Base}}{\text{KOH}(aq)} \longrightarrow \text{H}_2\text{O}(l) + \text{K}^+(aq) + \text{NO}_3^-(aq) \]
La forma netta, che mette in risalto lo scambio protonico, è semplicemente:
\[ \text{H}^+(aq) + \text{OH}^-(aq) \longrightarrow \text{H}_2\text{O}(l) \]
Le interazioni acido–base sono pervasive nella chimica e nella biochimica, dall’equilibrio ematico acido carbonico/idrogenocarbonato agli enzimi con residui catalitici protonabili.
Ossidazioni e riduzioni: elettroni e numeri di ossidazione
Nelle reazioni redox avviene un trasferimento netto di elettroni: la specie che cede elettroni si ossida, mentre quella che li acquista si riduce. Un sistema paradigmatico è il ferro metallico immerso in una soluzione contenente ioni rame(II):
\[ \underset{\text{si ossida}}{\text{Fe}(s)} + \underset{\text{si riduce}}{\text{Cu}^{2+}(aq)} \longrightarrow \text{Fe}^{2+}(aq) + \text{Cu}(s) \]
Il ferro perde due elettroni (passando da Fe a Fe2+), che vengono acquisiti dal rame(II) (da Cu2+ a Cu). Per seguire in modo sistematico queste trasformazioni si impiegano i numeri di ossidazione.
Il numero di ossidazione (n.o.) di un atomo in una specie chimica è la carica formale che l’atomo avrebbe se gli elettroni di legame fossero assegnati interamente all’elemento più elettronegativo del legame. In tal modo, il n.o. riflette la direzione della polarizzazione elettronica e si esprime come intero positivo, negativo o zero. In composti ionici puri, i n.o. coincidono con le cariche ioniche; in composti covalenti, si ottengono applicando la convenzione di assegnare la coppia di legame all’atomo più elettronegativo.
Per molecole organiche, il n.o. del carbonio in un dato ambiente si può valutare “scomponendo” idealmente i legami del carbonio considerato e attribuendo contributi elementari in base all’elettronegatività relativa:
- contributo 0 per un legame C–C;
- contributo +1 per ogni legame C–X con X più elettronegativo del carbonio (per esempio O, N, F, Cl);
- contributo −1 per ogni legame C–Y con Y meno elettronegativo del carbonio (per esempio H, metalli).
La somma algebrica dei contributi fornisce il n.o. del carbonio. Nella molecola seguente sono riportati i numeri di ossidazione dei due atomi di carbonio, calcolati sulla base dei valori di elettronegatività indicati in rosso.
 |
| Serie di composti organici ordinati per stato di ossidazione del carbonio. |
Regole operative utili per assegnare i numeri di ossidazione includono:
- Elementi allo stato nativo: in qualunque sostanza elementare (Na, Zn, Cu, N2, O2, Cl2, H2, S8, P4), ogni atomo ha n.o. 0;
- Idrogeno nei composti: n.o. +1, salvo negli idruri di metalli o del boro, dove è −1;
- Ossigeno nei composti: n.o. usuale −2; eccezioni nei perossidi (H2O2, n.o. −1), nei superossidi (KO2, n.o. −1/2) e in OF2 dove, essendo F più elettronegativo, O ha n.o. +2;
- Ioni monoatomici: il n.o. coincide con la carica (Na+ +1; Mg2+ +2; Fe3+ +3; Cl− −1; O2− −2); per gli ioni dei metalli alcalini è sempre +1, per gli alcalino-terrosi +2;
- Composti elettricamente neutri: la somma algebrica dei n.o. degli atomi è 0;
- Ioni poliatomici: la somma algebrica dei n.o. è pari alla carica complessiva dello ione.
Applicando queste regole si ricavano, per esempio:
- in H2SO4, con H a +1 e O a −2, lo zolfo risulta a +6 (2 − 8 + x = 0 → x = +6);
- in KMnO4, con K a +1 e O a −2, il manganese è a +7 (1 + x − 8 = 0 → x = +7);
- in NH4+, con H a +1, l’azoto è a −3 (x + 4 = +1 → x = −3);
- in ClO3−, con O a −2, il cloro è a +5 (x − 6 = −1 → x = +5).
Rappresentare le precipitazioni con equazioni ioniche nette
Come redigere l’equazione ionica netta
L’equazione molecolare bilanciata riporta specie complessive ma, se i reagenti e i prodotti sono elettroliti forti, non esplicita come essi esistano effettivamente in soluzione. L’unico prodotto non dissociato è il solido precipitato (per esempio, AgCl), mentre le restanti specie sono presenti come ioni solvattati. Per rendere questa realtà chimica più trasparente, si impiegano le equazioni ioniche e, per focalizzarsi solo sulle specie che subiscono trasformazioni, le equazioni ioniche nette, dalle quali si eliminano gli ioni spettatori.
Procedura standard per ottenere l’equazione ionica netta di una precipitazione:
- Scrivere l’equazione molecolare bilanciata del processo e, usando le regole di solubilità (Tabella 04.04-01), identificare il precipitato;
- Espandere in ioni tutte le specie fortemente elettrolitiche in soluzione acquosa, mantenendo indissociate le fasi solide, liquide molecolari e gas;
- Eliminare, da entrambi i membri, gli ioni che compaiono inalterati (ioni spettatori), ottenendo così la forma netta;
- Verificare il bilanciamento di massa e di carica, come per ogni equazione chimica ben posta.
Le equazioni ioniche nette non sono utili solo per le precipitazioni; rappresentano in modo essenziale anche molte reazioni acido–base e processi redox in soluzione acquosa.
| Composti solubili | Eccezioni |
|---|---|
| Sali contenenti ioni alcalini (Li⁺, Na⁺, K⁺, Rb⁺, Cs⁺) e lo ione ammonio (NH₄⁺) | Nessuna |
| Nitrati (NO₃⁻), bicarbonati (HCO₃⁻) e clorati (ClO₃⁻) | Nessuna |
| Alogenuri (Cl⁻, Br⁻, I⁻) | Poco solubili se combinati con Ag⁺, Hg₂²⁺, Pb²⁺ |
| Solfati (SO₄²⁻) | Limitata solubilità con Ca²⁺, Sr²⁺, Ba²⁺, Hg₂²⁺, Pb²⁺ |
| Acetati (CH₃COO⁻) | Generalmente solubili senza eccezioni clinicamente rilevanti |
| Perclorati (ClO₄⁻) | Normalmente solubili, eccezioni rare |
| Composti insolubili | Eccezioni |
| Carbonati (CO₃²⁻), fosfati (PO₄³⁻), cromati (CrO₄²⁻) e solfuri (S²⁻) | Solubili se associati a ioni alcalini e NH₄⁺ |
| Idrossidi (OH⁻) | Solubili con ioni alcalini e Ba²⁺; parzialmente con Ca²⁺ e Sr²⁺ |
| Ossalati (C₂O₄²⁻) | Solubili con ioni alcalini e NH₄⁺ |
| Fluoruri (F⁻) | Solubili con alcalini, scarsa solubilità con Mg²⁺ e Ca²⁺ |
Solubilità dei sali ionici
Proprietà di solubilità di diversi composti ionici diffusi.
| Composti solubili | Eccezioni |
|---|---|
| Sali contenenti ioni alcalini (Li⁺, Na⁺, K⁺, Rb⁺, Cs⁺) e lo ione ammonio (NH₄⁺) | Nessuna |
| Nitrati (NO₃⁻), bicarbonati (HCO₃⁻) e clorati (ClO₃⁻) | Nessuna |
| Alogenuri (Cl⁻, Br⁻, I⁻) | Poco solubili se combinati con Ag⁺, Hg₂²⁺, Pb²⁺ |
| Solfati (SO₄²⁻) | Limitata solubilità con Ca²⁺, Sr²⁺, Ba²⁺, Hg₂²⁺, Pb²⁺ |
| Acetati (CH₃COO⁻) | Generalmente solubili senza eccezioni clinicamente rilevanti |
| Perclorati (ClO₄⁻) | Normalmente solubili, eccezioni rare |
| Composti insolubili | Eccezioni |
| Carbonati (CO₃²⁻), fosfati (PO₄³⁻), cromati (CrO₄²⁻) e solfuri (S²⁻) | Solubili se associati a ioni alcalini e NH₄⁺ |
| Idrossidi (OH⁻) | Solubili con ioni alcalini e Ba²⁺; parzialmente con Ca²⁺ e Sr²⁺ |
| Ossalati (C₂O₄²⁻) | Solubili con ioni alcalini e NH₄⁺ |
| Fluoruri (F⁻) | Solubili con alcalini, scarsa solubilità con Mg²⁺ e Ca²⁺ |
Solubilità dei sali ionici
Proprietà di solubilità di diversi composti ionici diffusi.