La meiosi riduce il numero di cromosomi da diploide ad aploide
Definizione
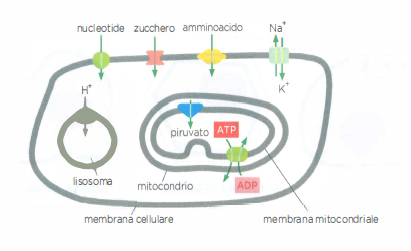
I trasportatori di membrana sono proteine integrali specializzate nel trasferimento attraverso i doppî strati lipidici della gran parte delle piccole molecole idrosolubili e di specifici ioni inorganici. La loro attività è altamente selettiva: ciascun trasportatore riconosce con elevata specificità una o poche specie molecolari. Per assicurare un flusso ordinato di soluti tra citosol e organuli, ogni membrana biologica ospita un corredo distinto di trasportatori coerente con la funzione del compartimento. La membrana plasmatica, ad esempio, esprime trasportatori per l’ingresso di nutrienti quali zuccheri, amminoacidi e nucleotidi; la membrana lisosomiale contiene una pompa per H⁺ che acidifica il lume lisosomiale, oltre a trasportatori deputati a riversare nel citosol i prodotti della digestione; la membrana interna mitocondriale possiede carrier che importano piruvato, combustibile per la sintesi di ATP, e sistemi che scambiano nucleotidi, consentendo l’uscita dell’ATP neoformato (Figura 05.05-01). Seguono i principi generali di funzionamento dei trasportatori e i meccanismi molecolari che governano il movimento di soluti di rilevanza fisiologica.
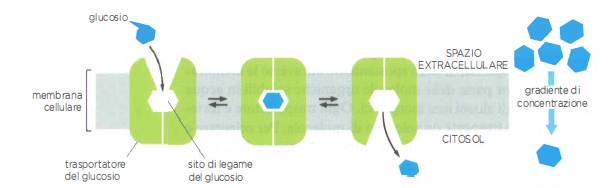
Un modello classico di trasporto passivo mediato da carrier è offerto dai trasportatori del glucosio presenti nella membrana plasmatica di numerosi tipi cellulari dei mammiferi. Queste proteine multipasso, costituite da un’unica catena polipeptidica che attraversa la membrana più volte, operano secondo il principio dell’accesso alternante: lo stesso sito di legame per il soluto viene esposto, in modo reversibile e stocastico, prima su un lato della membrana e poi sull’altro. Poiché il glucosio è elettricamente neutro, il suo gradiente elettrochimico coincide con il gradiente di concentrazione, descritto da: \(\Delta \mu = RT \ln\!\left(\frac{[glucosio]_{in}}{[glucosio]_{out}}\right)\). La direzione del flusso netto è quindi determinata dal segno di tale termine.
In condizioni di abbondanza di glucosio extracellulare, ad esempio dopo l’assorbimento intestinale post-prandiale, il legame del glucosio al sito esposto verso l’esterno favorisce la transizione conformazionale che ne consente il rilascio nel citosol, dove la concentrazione è inferiore (Figura 05.05-02). In molte cellule, l’immediata fosforilazione a glucosio-6-fosfato riduce ulteriormente la concentrazione di glucosio libero intracellulare, mantenendo favorevole l’ingresso. In senso opposto, durante il digiuno l’azione del glucagone sugli epatociti stimola la mobilizzazione del glicogeno e la gluconeogenesi; la concentrazione citosolica di glucosio può allora superare quella esterna e il trasportatore, esponendo il sito verso il citosol, facilita l’uscita del monosaccaride, che diventa disponibile per altri distretti.
Questi carrier sono sia selettivi sia saturabili: riconoscono il D-glucosio con alta affinità, mentre la forma enantiomera L non viene praticamente traslocata. La cinetica del trasporto mostra comportamento analogo a quello enzimatico, con velocità che tende a una soglia massima al crescere della concentrazione del substrato. Pur non determinando la direzione del flusso, tale specificità assicura che solo i soluti compatibili con il sito di legame vengano trasferiti con efficienza.
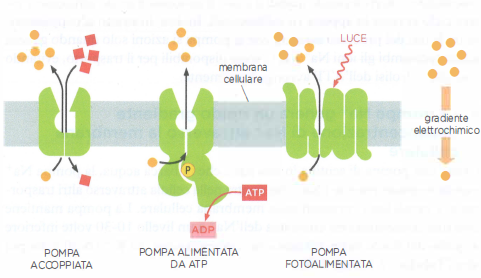
Il solo trasporto passivo non è sufficiente a mantenere l’omeostasi ionica e metabolica. Quando un soluto deve essere spostato contro il proprio gradiente elettrochimico, le cellule impiegano pompe transmembrana che forniscono energia al processo secondo tre strategie principali (Figura 05.05-03):
- trasportatori accoppiati, che collegano il movimento “a valle” di un soluto all’ingresso o all’uscita “in salita” di un altro soluto, realizzando simporto o antiporto;
- pompe ATP-driven, che ricavano energia dall’idrolisi di ATP e trasferiscono direttamente il gruppo fosfato o sfruttano cambi conformazionali indotti dall’energia liberata;
- pompe fotoattivate, tipiche soprattutto di procarioti, che utilizzano l’energia luminosa per generare gradienti ionici, come accade con la batteriorodopsina.
Questi meccanismi sono funzionalmente interconnessi. Nelle cellule animali, una pompa ATP-dipendente espelle Na⁺ creando un forte gradiente transmembrana; il rientro di Na⁺ lungo tale gradiente, attraverso trasportatori accoppiati, fornisce la forza motrice per l’importazione “secondaria attiva” di numerosi nutrienti e ioni. L’inibizione della pompa del sodio esaurisce rapidamente il gradiente, arrestando i processi dipendenti dall’accoppiamento al Na⁺. In piante, funghi e molti batteri, un ruolo analogo è svolto dalle pompe dei protoni che estrudono H⁺ e costruiscono un gradiente elettrochimico di protoni utilizzato in seguito per l’assorbimento di soluti.
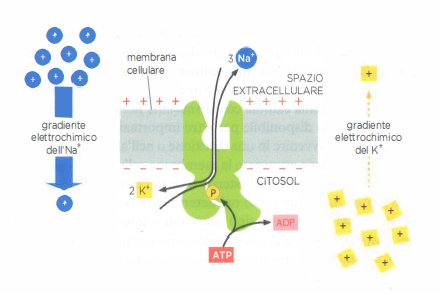
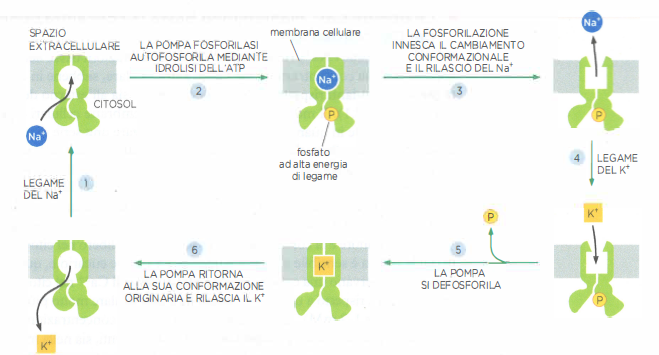
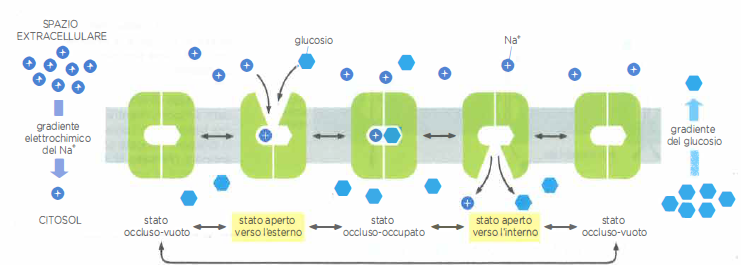
La Na⁺/K⁺-ATPasi è una P-type ATPasi cruciale per l’equilibrio ionico e il bilancio energetico cellulare. In molte cellule animali essa consuma una frazione consistente dell’ATP disponibile, spesso nell’ordine del 20–40% del totale. Ogni ciclo catalitico, accoppiato all’idrolisi di una molecola di ATP, trasferisce tipicamente 3 ioni Na⁺ verso l’esterno e 2 ioni K⁺ verso l’interno, generando un flusso elettrogenico. L’energia dell’idrolisi fosforila transitoriamente un residuo dell’enzima e innesca una sequenza ordinata di cambi conformazionali che alternano stati con siti ionici accessibili al citosol o al versante extracellulare (Figura 05.05-04).
Il ciclo di trasporto procede per tappe interdipendenti, ciascuna condizionata dalla precedente e dalla disponibilità degli ioni appropriati (Figura 05.05-05). Tale accoppiamento stretto previene l’idrolisi “futile” dell’ATP quando Na⁺ o K⁺ mancano. Molecole inibitrici come la ouabaina bloccano la pompa stabilizzando stati conformazionali specifici e impedendo, ad esempio, il legame del K⁺ extracellulare, con interruzione dell’intero ciclo. La cinetica è rapida: un ciclo completo richiede tipicamente pochi millisecondi, per esempio circa 8 ms. Oltre a sostenere il trasporto accoppiato al Na⁺, l’attività della Na⁺/K⁺-ATPasi contribuisce al potenziale di membrana e al controllo del volume cellulare, bilanciando l’osmosi e mantenendo la tonicità interna.
La Na⁺/K⁺-ATPasi, nota comunemente come “pompa del sodio e del potassio”, utilizza l’energia ricavata dall’idrolisi di ATP per espellere ioni Na⁺ dal citoplasma e importare ioni K⁺, con una stechiometria tipica di 3 Na⁺ estrusi per 2 K⁺ introdotti per ciascuna molecola di ATP consumata. In tal modo mantiene la concentrazione citosolica di Na⁺ da 10 a 30 volte inferiore rispetto a quella del liquido extracellulare e, al contempo, una concentrazione di K⁺ intracellulare da 10 a 30 volte più elevata (Tabella 05.05-02). Questa attività elettrogenica contribuisce sia al gradiente di concentrazione sia al potenziale di membrana che, insieme, determinano il gradiente elettrochimico di Na⁺ che favorisce l’ingresso dello ione nella cellula (Figura 05.05-12).
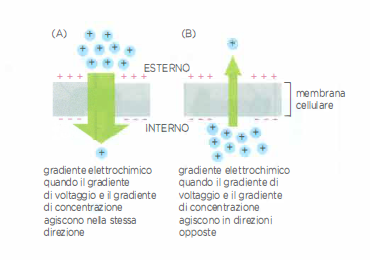
L’energia libera associata al gradiente di Na⁺ può essere espressa come differenza di potenziale chimico-elettrostatico: \[ \Delta \mu_{\mathrm{Na^+}} = RT \ln\!\left(\frac{[\mathrm{Na^+}]_{\mathrm{in}}}{[\mathrm{Na^+}]_{\mathrm{out}}}\right) + zF\Delta\Psi, \] dove \(R\) è la costante dei gas, \(T\) la temperatura assoluta, \(z\) la valenza dello ione (per Na⁺, \(z=+1\)), \(F\) la costante di Faraday e \(\Delta\Psi\) il potenziale transmembrana. Un valore intracellulare di Na⁺ basso e un potenziale negativo all’interno rendono \(\Delta \mu_{\mathrm{Na^+}}\) fortemente favorevole all’ingresso dello ione.
L’elevata concentrazione di Na⁺ al di fuori della cellula, in presenza di un potenziale di membrana negativo, rappresenta una riserva di energia paragonabile a un bacino d’acqua a monte di una diga: può essere “sfruttata” per alimentare trasporti secondari di numerosi soluti (Figura 05.05-06). Anche se l’enzima viene inibito farmacologicamente, ad esempio con ouabaina, il serbatoio energetico accumulato dal gradiente di Na⁺ è sufficiente a sostenere per alcuni minuti il funzionamento dei trasportatori accoppiati alimentati dal flusso di Na⁺ secondo gradiente, prima che il gradiente stesso si dissipi in modo significativo.
| Ione | Concentrazione intracellulare (mM) | Concentrazione extracellulare (mM) |
|---|---|---|
| Na⁺ | 5–15 | 145 |
| K⁺ | ~140 | 5 |
| Mg²⁺ | ~0,5 (ioni liberi) | 1–2 |
| Ca²⁺ | 10⁻⁴ | 1–2 |
| H⁺ | 7 × 10⁻⁵ (pH ~7,2) | 4 × 10⁻⁵ (pH ~7,4) |
| Cl⁻ | 5–15 | 110 |
Distribuzione ionica nelle cellule dei mammiferi
Le cellule dei mammiferi mantengono un preciso gradiente ionico tra interno ed esterno, fondamentale per l’omeostasi e la trasmissione dei segnali. Alte concentrazioni di sodio e cloro caratterizzano l’ambiente extracellulare, mentre il potassio predomina nel citoplasma. Il calcio libero intracellulare rimane a livelli estremamente bassi, garantendo la corretta regolazione di processi come contrazione muscolare e segnalazione intracellulare.
Il Ca²⁺ intracellulare libero è mantenuto su valori estremamente bassi, tipicamente intorno a 10⁻⁴ mM (≈100 nM), a fronte di concentrazioni extracellulari nell’ordine di 1–2 mM (Tabella 05.05-02). Tale differenza è cruciale perché il Ca²⁺ funge da segnale intracellulare: rapidi aumenti transitori del Ca²⁺ citosolico regolano processi come l’esocitosi sinaptica, la contrazione muscolare, la fecondazione e molte vie di segnalazione. Quanto più bassa è la concentrazione basale, tanto maggiore è la sensibilità della cellula ai segnali che ne incrementano il valore.
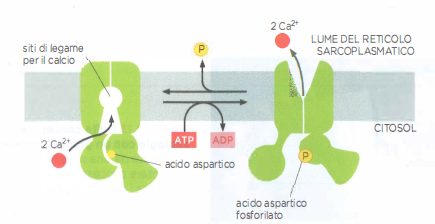
Il mantenimento di un Ca²⁺ citosolico basso dipende principalmente da pompe Ca²⁺-ATPasi localizzate nella membrana plasmatica (PMCA) e nel reticolo endoplasmatico/sarcoplasmatico (SERCA). Queste proteine appartengono alla famiglia delle ATPasi di tipo P e, analogamente alla pompa Na⁺/K⁺ (Figura 05.05-05), attraversano stati conformazionali fosforilati per traslocare lo ione. La pompa del Ca²⁺, tuttavia, completa il ciclo senza richiedere il legame e il co-trasporto di un secondo catione, come illustrato in (Figura 05.05-07). La similarità di sequenza e di architettura con la Na⁺/K⁺-ATPasi suggerisce un’origine evolutiva comune.
La cellula integra il lavoro delle pompe con sistemi di buffering e di compartimentalizzazione: proteine leganti Ca²⁺ (ad esempio calmodulina o calsequestrina), depositi nei lumi del reticolo endoplasmatico e del reticolo sarcoplasmatico, e assorbimento mitocondriale contribuiscono a limitare e modellare le oscillazioni del segnale calcio-dipendente. La rimozione attiva di Ca²⁺ dal citosol, contro il suo ripido gradiente, è pertanto un requisito per la corretta temporizzazione e chiusura dei processi regolati dal Ca²⁺.
| Ione | Concentrazione intracellulare (mM) | Concentrazione extracellulare (mM) |
|---|---|---|
| Na⁺ | 5–15 | 145 |
| K⁺ | ~140 | 5 |
| Mg²⁺ | ~0,5 (ioni liberi) | 1–2 |
| Ca²⁺ | 10⁻⁴ | 1–2 |
| H⁺ | 7 × 10⁻⁵ (pH ~7,2) | 4 × 10⁻⁵ (pH ~7,4) |
| Cl⁻ | 5–15 | 110 |
Distribuzione ionica nelle cellule dei mammiferi
Le cellule dei mammiferi mantengono un preciso gradiente ionico tra interno ed esterno, fondamentale per l’omeostasi e la trasmissione dei segnali. Alte concentrazioni di sodio e cloro caratterizzano l’ambiente extracellulare, mentre il potassio predomina nel citoplasma. Il calcio libero intracellulare rimane a livelli estremamente bassi, garantendo la corretta regolazione di processi come contrazione muscolare e segnalazione intracellulare.
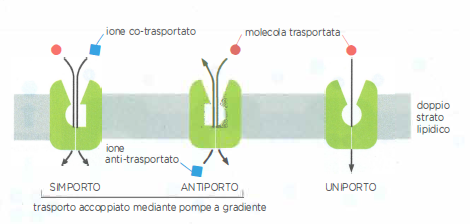
Un gradiente di concentrazione o di potenziale elettrico attraverso una membrana può essere convertito in lavoro utile per trasportare altri soluti contro gradiente. È il principio del trasporto attivo secondario: il flusso spontaneo del “soluto motore” fornisce l’energia necessaria per accumulare o espellere un secondo soluto. I trasportatori che realizzano tale accoppiamento sono detti trasportatori accoppiati (Figura 05.05-03):
- Se due soluti attraversano la membrana nella stessa direzione, il meccanismo è un simporto;
- se si muovono in direzioni opposte, si parla di antiporto;
- se il trasporto riguarda un solo tipo di soluto, si tratta di un uniporto non accoppiato (Figura 05.05-08).
Le combinazioni possibili includono ione/ione, ione/molecola organica o molecola organica/molecola organica. Un classico uniporto è il trasportatore passivo del glucosio, che consente il flusso secondo gradiente senza spesa diretta di ATP (Figura 05.05-02). In tutti i casi, l’efficacia del trasporto accoppiato dipende dall’entità del gradiente che lo alimenta e dalla cinetica del trasportatore stesso.
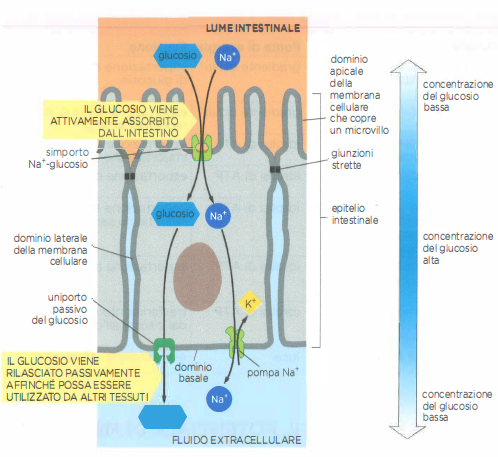
Nelle cellule animali, i simporti guidati dall’ingresso di Na⁺ sono ampiamente impiegati per l’assorbimento di nutrienti e ioni. Le cellule epiteliali dell’intestino tenue ne forniscono un esempio paradigmatico: la membrana apicale, rivolta verso il lume, esprime simporti Na⁺/glucosio che utilizzano l’energia del gradiente elettrochimico del sodio per introdurre glucosio anche quando la sua concentrazione citosolica è superiore a quella luminale. Il legame di Na⁺ e glucosio al trasportatore è cooperativo, per cui l’affinità per uno dei due aumenta quando l’altro è già legato; in assenza di uno dei due ligandi, il ciclo di trasporto non procede (Figura 05.05-09).
Per realizzare il trasferimento vettoriale del glucosio dall’intestino al sangue, gli enterociti organizzano i trasportatori in domini di membrana distinti: i simporti Na⁺/glucosio sono confinati al polo apicale, mentre nella membrana baso-laterale sono presenti uniporti del glucosio che consentono il rilascio passivo verso l’interstizio e quindi nel circolo ematico (Figura 05.05-10). Le giunzioni strette, situate in prossimità dell’orlo apicale, costituiscono una barriera alla diffusione laterale delle proteine di membrana, preservando la polarità funzionale dell’epitelio.
Oltre ai simporti, anche diversi antiporti dipendono dal gradiente di Na⁺. Lo scambiatore Na⁺/H⁺ (NHE) utilizza l’ingresso di Na⁺ per allontanare H⁺ dal citosol, contribuendo in modo significativo al controllo del pH intracellulare e alla risposta a carichi acidi. In vari tessuti si trovano ulteriori sistemi accoppiati, come gli scambiatori Na⁺/Ca²⁺, che supportano l’estrusione di Ca²⁺ quando il fabbisogno di rimozione supera la capacità delle pompe Ca²⁺-ATPasi. Tutti questi processi richiedono che la Na⁺/K⁺-ATPasi mantenga il gradiente di Na⁺: se la pompa viene inibita, l’efficienza dei trasportatori accoppiati crolla via via che il gradiente si riduce.
A differenza delle cellule animali, la maggior parte delle cellule di piante, funghi (inclusi i lieviti) e batteri non fa affidamento su pompe del Na⁺ nella membrana plasmatica. In questi organismi, il gradiente elettrochimico di H⁺ costituisce la fonte energetica principale per i trasportatori accoppiati. Le pompe protoniche espellono H⁺ verso l’esterno, generando sia un potenziale di membrana sia una differenza di pH, che rendono l’ambiente esterno relativamente acido e l’interno negativo. Il rientro di H⁺ secondo gradiente può quindi essere utilizzato per co-trasportare zuccheri, amminoacidi e altri nutrienti, analogamente a quanto fa il Na⁺ nelle cellule animali.
Le vie di generazione del gradiente protonico sono diverse. In molti batteri fotosintetici, proteine fotopompe come la batteriorodopsina trasferiscono H⁺ attraverso la membrana sfruttando l’energia luminosa. In piante, funghi e numerosi batteri, le H⁺-ATPasi di tipo P della membrana plasmatica idrolizzano ATP per pompare H⁺ verso l’esterno, in maniera concettualmente simile alle pompe Na⁺ e Ca²⁺ dei mammiferi descritte in precedenza. Inoltre, un’ATPasi protonica distinta, di tipo V, è localizzata nelle membrane di organuli intracellulari, quali i lisosomi delle cellule animali e il vacuolo centrale nelle cellule vegetali e fungine: questi complessi trasferiscono H⁺ dal citosol al lume organellare, acidificando l’interno dell’organulo e contribuendo al mantenimento di un pH citosolico prossimo alla neutralità.
L’acidità intraluminale è essenziale per la funzione di numerosi compartimenti cellulari, ad esempio per l’attivazione di idrolasi lisosomiali o per l’accumulo di metaboliti nel vacuolo.