La genetica mendeliana è governata dalle leggi della probabilità
Definizione
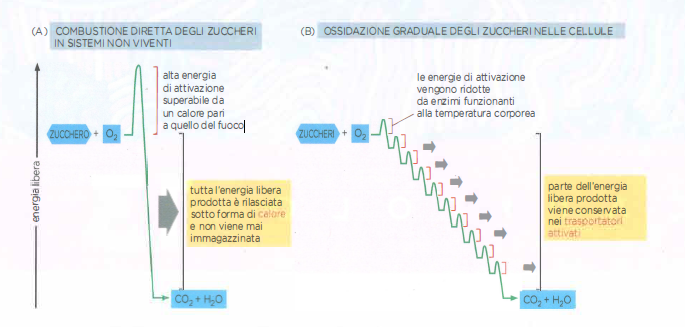
Se un combustibile biologico, come il glucosio, fosse trasformato in CO₂ e H₂O in un singolo evento di combustione, l’energia liberata supererebbe di gran lunga la capacità di cattura di qualunque trasportatore intracellulare di energia (Figura 05.09-01). Le cellule, invece, operano una combustione “a piccoli passi”: una sequenza di reazioni di ossidoriduzione, strettamente regolate e catalizzate da enzimi attivi alle temperature fisiologiche, frammenta gradualmente l’energia libera del substrato in quote gestibili e accoppiabili alla formazione di trasportatori ad alta energia (Figura 05.09-01). In questo modo, l’energia chimica contenuta nel glucosio viene convogliata, in misura prevalente, nei legami fosfoanidridici dell’ATP e in altri vettori riducenti, rendendola disponibile per il lavoro cellulare.
Negli animali, la formazione di ATP procede attraverso due strategie principali, che operano in sinergia:
- fosforilazione a livello del substrato, in cui reazioni esoergoniche della via catabolica sono accoppiate direttamente alla trasformazione energeticamente sfavorita \( \mathrm{ADP} + P_i \rightarrow \mathrm{ATP} \);
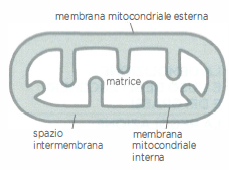
- fosforilazione ossidativa, nella quale l’energia immagazzinata in trasportatori ridotti (soprattutto NADH e FADH₂) alimenta, tramite il trasferimento di elettroni, la sintesi di ATP; questo processo avviene sulla membrana mitocondriale interna delle cellule eucariotiche (Figura 05.09-02) e, nei procarioti aerobici, sulla membrana plasmatica.
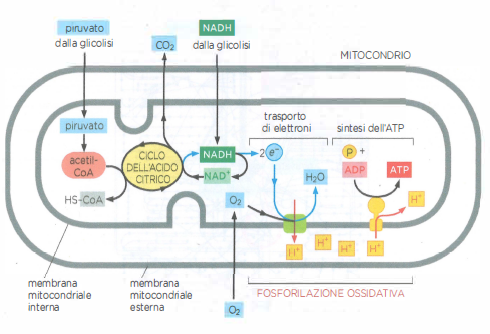
Nel seguito si considerano le reazioni iniziali che ossidano i nutrienti nel citosol e nella matrice mitocondriale (Figura 05.09-02). Tali reazioni forniscono una quota diretta di ATP e, soprattutto, generano i trasportatori ridotti che in seguito sosterranno la produzione della frazione maggiore di ATP mediante fosforilazione ossidativa.
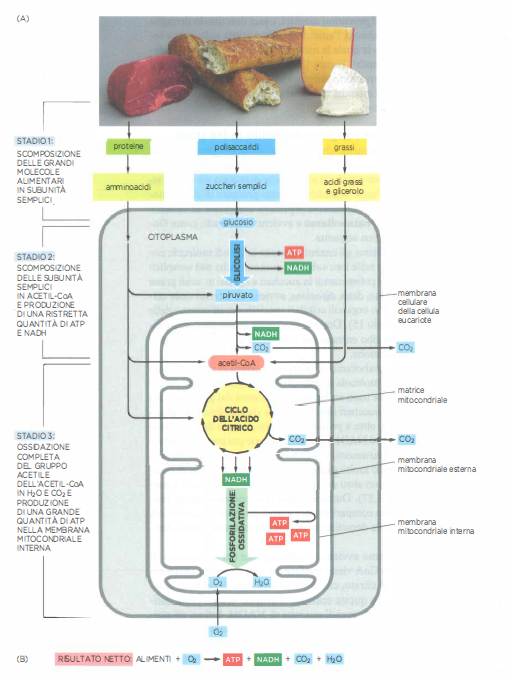
Le macromolecole alimentari — proteine, lipidi e polisaccaridi — devono essere convertite in unità più semplici per essere utilizzate come fonte energetica e come mattoni per la biosintesi. Questo insieme di trasformazioni degradative, denominato catabolismo, procede in tre stadi coordinati (Figura 05.09-03).
Stadio 1: digestione e depolimerizzazione. Enzimi idrolitici scindono le macromolecole nelle loro subunità: proteine in amminoacidi, carboidrati complessi in zuccheri semplici, trigliceridi in acidi grassi e glicerolo. Nella maggior parte degli animali, tali reazioni si svolgono nel lume intestinale; nelle cellule, processi analoghi avvengono in organuli dedicati come i lisosomi. I monomeri così generati entrano nel citosol, dove hanno inizio le tappe ossidative.
Stadio 2: ossidazione citosolica e attivazione mitocondriale. La glicolisi, via citosolica universale, converte una molecola di glucosio in due molecole di piruvato, producendo direttamente ATP e il trasportatore ridotto NADH. Zuccheri diversi dal glucosio possono confluire nella via dopo opportune conversioni in intermedi glicolitici. Il piruvato, quindi, viene importato nella matrice mitocondriale, dove il complesso della piruvato deidrogenasi rilascia CO₂ e forma acetil-CoA, generando ulteriore NADH. Nella stessa sede, gli acidi grassi subiscono β-ossidazione, una sequenza ciclica che produce grandi quantità di acetil-CoA oltre a NADH e FADH₂ (Figura 05.09-03).
Stadio 3: ossidazione completa e cattura dell’energia nei mitocondri. Il gruppo acetile dell’acetil-CoA si condensa con ossalacetato per formare citrato, che entra nel ciclo dell’acido citrico. Durante il ciclo, il carbonio acetilico viene completamente ossidato a CO₂ e si accumulano equivalenti riducenti, principalmente NADH e FADH₂. Gli elettroni ad alta energia vengono quindi trasferiti alla catena di trasporto degli elettroni localizzata nella membrana mitocondriale interna. L’energia liberata dal flusso elettronico pompa protoni nello spazio intermembrana, generando una forza proton-motrice che alimenta la fosforilazione ossidativa e la sintesi di ATP consumando ossigeno molecolare, l’accettore finale di elettroni.
La resa energetica della cellula è sostanziale: una frazione consistente, tipicamente intorno al 40–55 %, dell’energia teoricamente estraibile dall’ossidazione completa di zuccheri e acidi grassi viene catturata nella reazione sfavorita \( \mathrm{ADP} + P_i \rightarrow \mathrm{ATP} \), valore che supera di molto l’efficienza di un moderno motore a combustione interna, che raramente oltrepassa il 20 % in condizioni operative. L’energia non catturata viene dissipata come calore, contribuendo alla termoregolazione in molti organismi omeotermi.
Le concentrazioni intracellulari di ATP sono elevate e dinamiche: in una tipica cellula eucariotica si stima una dotazione di circa 1–2×10⁹ molecole di ATP in continuo ricambio, con tempi di turnover inferiori a 1 minuto in condizioni metaboliche attive. Su scala dell’intero organismo, un adulto a riposo rigenera quotidianamente un ammontare di ATP paragonabile a 50–70 kg di molecole, cifra che riflette l’intenso flusso energetico necessario al mantenimento dell’omeostasi.
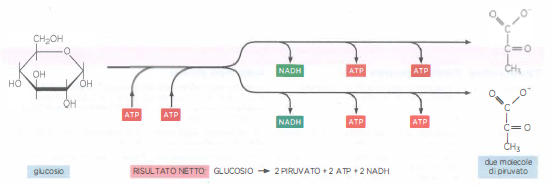
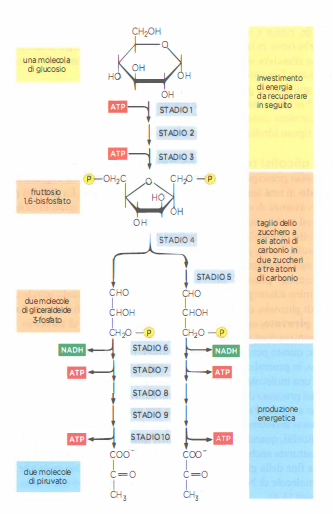
La trasformazione centrale dello stadio 2 è la glicolisi, via citosolica antica e ampiamente conservata che funziona in assenza di ossigeno in quasi tutte le cellule, inclusi numerosi microrganismi anaerobi. Il termine, dal greco glykys (dolce) e lýsis (scissione), descrive la conversione di un esoso in due triosi: una molecola di glucosio a sei atomi di carbonio viene scissa in due molecole di piruvato a tre atomi di carbonio. La ridistribuzione degli elettroni durante la via comporta un calo dell’energia libera del sistema, poiché gli elettroni nel piruvato risultano in media in uno stato energetico inferiore rispetto a quelli del glucosio.
La via si articola in due fasi funzionali:
- fase di investimento, in cui due molecole di ATP vengono consumate per fosforilare e rendere più reattivo lo zucchero, predisponendolo alla scissione aldolica;
- fase di rendimento, in cui si formano quattro ATP per fosforilazione a livello del substrato e si accumulano equivalenti riducenti sotto forma di NADH, attraverso la reazione \( \mathrm{NAD}^+ + 2 e^- + H^+ \rightarrow \mathrm{NADH} \).
Il bilancio netto, per ogni glucosio, è quindi di due ATP e due NADH, oltre a due piruvati pronti per l’ossidazione mitocondriale (Figura 05.09-04). Zuccheri diversi (ad esempio fruttosio e galattosio) possono entrare nella rete metabolica dopo conversione in intermedi come fruttosio-6-fosfato o glucosio-6-fosfato. In condizioni di carenza di ossigeno, molte cellule rigenerano \( \mathrm{NAD}^+ \) riducendo il piruvato a lattato o convertendolo in etanolo e CO₂, mantenendo così il flusso glicolitico; in presenza di ossigeno, invece, il piruvato è preferenzialmente decarbossilato ad acetil-CoA nella matrice mitocondriale, e i NADH prodotti nella glicolisi alimentano la catena respiratoria tramite navette redox specifiche.
La glicolisi, unita alla successiva ossidazione del piruvato e al ciclo dell’acido citrico, funge da snodo metabolico che collega l’apporto alimentare al lavoro chimico, meccanico ed osmotico della cellula, traducendo l’energia dei legami C–C e C–H in quanti di energia prontamente utilizzabili dall’ATP sintasi e da molte reazioni accoppiate.
La definizione completa della via glicolitica, ottenuta negli anni ’30 del Novecento, rappresenta un traguardo storico della biochimica: la sequenza comprende 10 trasformazioni enzimatiche distinte, ciascuna con specifici intermedi e catalizzata da un enzima diverso, come schematizzato in (Figura 05.09-05). La nomenclatura degli enzimi coinvolti segue la convenzione generale in -asi (per esempio, isomerasi, deidrogenasi), indicativa della classe di reazione catalizzata (Tabella 05.09-01). Una quota sostanziale dell’energia chimica liberata dalla degradazione del glucosio è convogliata nella sintesi di ATP a partire da ADP e \(P_i\) per fosforilazione a livello di substrato: nella via glicolitica ciò avviene alle tappe 7 e 10, dove un gruppo fosfato ad alta energia viene trasferito direttamente da un intermedio fosforilato all’ADP, generando ATP. Questo meccanismo è l’inverso della più comune fosforilazione cellulare, in cui l’ATP cede il proprio fosfato a un substrato.
L’energia rimanente viene immagazzinata come potenziale redox negli equivalenti riducenti, in particolare nelle molecole di NADH formate alla tappa 6 per ossidazione della gliceraldeide 3-fosfato. La reazione redox non richiede necessariamente ossigeno: è sufficiente un trasferimento di elettroni tra specie chimiche. In assenza di O₂ molecolare, può comunque verificarsi ossidazione se un accettore di elettroni alternativo è disponibile. Nella glicolisi, un idruro \(\mathrm{H^-}\) viene estratto dalla gliceraldeide 3-fosfato e trasferito al NAD⁺, producendo NADH. Per ogni molecola di glucosio si ottengono due molecole di NADH e, al netto dell’investimento iniziale, due molecole di ATP.
Negli eucarioti, il NADH citosolico prodotto dalla glicolisi alimenta la catena di trasporto degli elettroni nella membrana mitocondriale interna, direttamente o tramite navette metaboliche, dove gli elettroni vengono infine trasferiti all’O₂ per formare H₂O. La cessione degli elettroni rigenera NAD⁺, necessario per mantenere il flusso glicolitico. In condizioni di scarsa disponibilità di ossigeno, la rigenerazione di NAD⁺ può avvenire tramite vie alternative che producono energia, come la fermentazione, descritta oltre.
| Tipo di enzima | Funzione generale | Ruolo nella glicolisi |
|---|---|---|
| Chinasi | Aggiungono gruppi fosfato a specifici substrati | Trasferiscono un fosfato dall’ATP nelle prime fasi (stadi 1 e 3); nelle fasi finali (stadio 7 e 10) catalizzano la produzione di ATP trasferendo un fosfato all’ADP |
| Isomerasi | Riorganizzano i legami interni di una molecola | Negli stadi 2 e 5 convertono zuccheri in forme isomeriche necessarie per le reazioni successive |
| Deidrogenasi | Catalizzano l’ossidazione rimuovendo atomi di idrogeno con relativi elettroni | Allo stadio 6, la gliceraldeide-3-fosfato deidrogenasi produce NADH e un intermedio ad alta energia |
| Mutasi | Spostano un gruppo funzionale da una posizione all’altra della stessa molecola | Alla tappa 8, una fosfoglicerato mutasi trasferisce un gruppo fosfato interno preparando la molecola alla sintesi di ATP nello stadio 10 |
Enzimi chiave della glicolisi
Il percorso glicolitico dipende da diversi tipi di enzimi che guidano fosforilazioni, isomerizzazioni, ossidazioni e riarrangiamenti interni. Questi catalizzatori assicurano il flusso energetico dalla degradazione del glucosio alla formazione di ATP e intermedi riducenti, costituendo la base del metabolismo energetico cellulare.
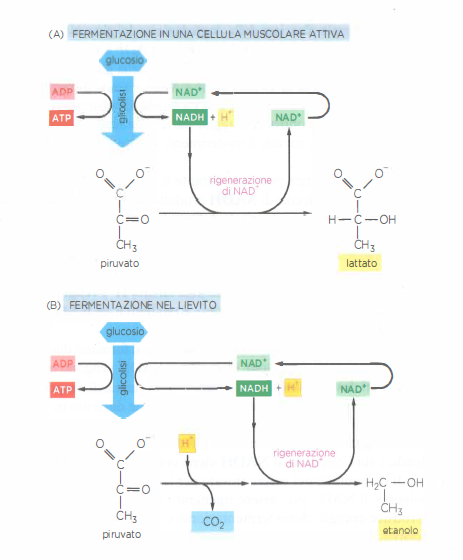
Nelle cellule di animali e piante, la glicolisi costituisce generalmente un passaggio preliminare rispetto alla produzione massiva di ATP nei mitocondri tramite fosforilazione ossidativa, processo dipendente dall’ossigeno. Per numerosi microrganismi anaerobi, invece, la glicolisi rappresenta la principale fonte di ATP; analogamente, in tessuti come il muscolo scheletrico, l’attività può proseguire a basse tensioni di O₂ grazie al contributo della glicolisi anaerobia. In assenza di ossigeno, piruvato e NADH restano nel citosol (Figura 05.09-03) e vengono convogliati in reazioni che consentono di smaltire elettroni in eccesso rigenerando NAD⁺, condizione indispensabile affinché la glicolisi continui.
Il destino del piruvato dipende dal sistema biologico. Nelle fibre muscolari, il piruvato viene ridotto a lattato; nei lieviti impiegati in panificazione e fermentazioni alcoliche, viene decarbossilato a acetaldeide e successivamente ridotto a etanolo, con rilascio di CO₂. In entrambi i casi il NADH dona gli elettroni e ritorna a NAD⁺, sostenendo il bilancio redox necessario alla produzione netta di ATP per fosforilazione a livello di substrato. Queste vie cataboliche anaerobie, che ossidano parzialmente gli zuccheri in assenza di O₂, sono denominate fermentazioni (Figura 05.09-06). A titolo di confronto, molti batteri e archei sono capaci di respirazione anaerobica, che impiega una catena di trasporto degli elettroni di membrana e utilizza accettori finali diversi dall’ossigeno:
- Fermentazione lattica: rigenera NAD⁺ riducendo il piruvato a lattato; tipica di cellule muscolari e di vari batteri lattici;
- Fermentazione alcolica: converte il piruvato in etanolo e CO₂ via acetaldeide, che funge da accettore degli elettroni del NADH; caratteristica dei lieviti e di alcuni microrganismi;
- Respirazione anaerobica: presenza di catena respiratoria con accettori terminali alternativi, per esempio nitrato (\(\mathrm{NO_3^-}\)), solfato (\(\mathrm{SO_4^{2-}}\)) o fumarato, localizzata nella membrana plasmatica dei procarioti.
La resa energetica della sola glicolisi può essere riassunta dalla stechiometria globale:
\[ \mathrm{Glucosio + 2\,ADP + 2\,P_i + 2\,NAD^+ \rightarrow 2\,Piruvato + 2\,ATP + 2\,NADH + 2\,H^+ + 2\,H_2O}. \]
In condizioni anaerobiche, la riconversione di NADH a NAD⁺ mediante fermentazione mantiene attiva la via, consentendo di sostenere un flusso di ATP pur in assenza di fosforilazione ossidativa.
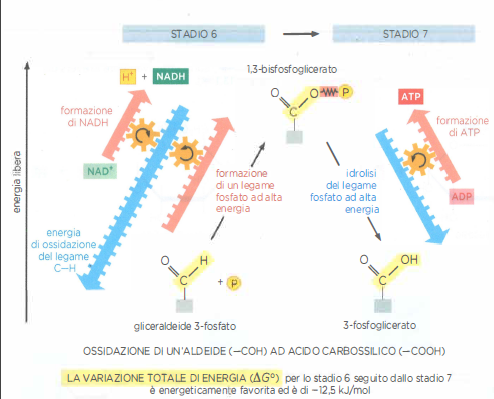
Le cellule ricavano lavoro utile dall’ossidazione dei composti organici grazie all’accoppiamento tra trasformazioni energeticamente sfavorite e processi termodinamicamente favoriti. Un esempio didatticamente rilevante è offerto dalla coppia di reazioni delle tappe 6 e 7 della glicolisi, che trasformano la gliceraldeide 3-fosfato (un’aldeide a tre atomi di carbonio) in 3-fosfoglicerato (un acido carbossilico), come illustrato complessivamente in (Figura 05.09-07). Nell’insieme, l’ossidazione dell’aldeide fornisce l’energia libera necessaria per due eventi chiave: la riduzione di NAD⁺ a NADH (tappa 6) e la formazione di ATP a partire da ADP mediante trasferimento di un fosfato ad alta energia (tappa 7). L’energia totale resa disponibile, parte della quale è dissipata come calore, rende la sequenza nel suo complesso favorita, con \(\Delta G^\circ \approx -12,5\ \mathrm{kcal/mol}\).
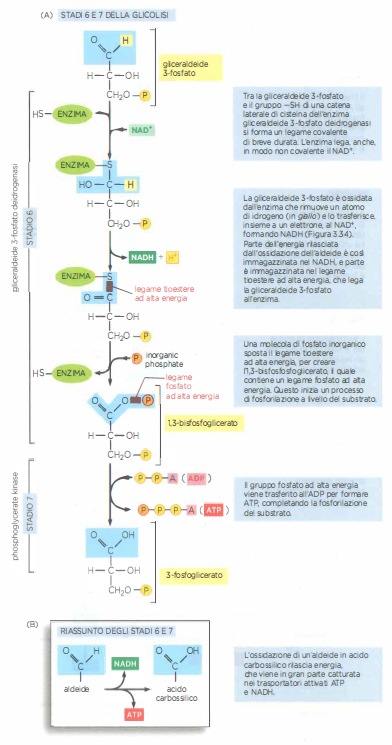
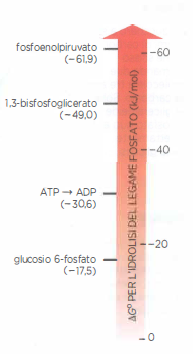
La tappa 6 è peculiare perché genera direttamente un legame fosfato ad alta energia utilizzando fosfato inorganico. L’enzima gliceraldeide 3-fosfato deidrogenasi forma un intermedio tioestere con un residuo di cisteina nel sito attivo; questo intermedio eleva l’energia del sistema e facilita l’attacco nucleofilo del \(P_i\), producendo 1,3-bisfosfoglicerato, un acil-fosfato con energia di idrolisi superiore a quella dei legami fosfoanidridici dell’ATP. La tappa 7, catalizzata dalla fosfoglicerato chinasi, sfrutta tale intermedio per trasferire il gruppo fosfato all’ADP, generando ATP per fosforilazione a livello di substrato. La (Figura 05.09-09) dettaglia la formazione e l’utilizzo del legame ad alta energia nello stadio 6 e il suo consumo nello stadio 7.
Il confronto tra l’energia di idrolisi dei diversi legami fosforici formati nella via è mostrato in (Figura 05.09-08): i legami fosfoanidridici dell’ATP coesistono con legami a energia ancora più elevata, come gli acil-fosfati (ad esempio 1,3-bisfosfoglicerato) e i fosfoenolici. Definiamo “ad alta energia” quei legami la cui idrolisi comporta una variazione di energia libera standard fortemente negativa; questa denominazione non implica instabilità intrinseca della molecola, ma riflette le condizioni termodinamiche della reazione di idrolisi:
- Stadio 6: ossidazione della gliceraldeide 3-fosfato con formazione di un intermedio tioestere e riduzione di NAD⁺ a NADH; incorporazione di \(P_i\) per generare 1,3-bisfosfoglicerato;
- Stadio 7: trasferimento del fosfato ad alta energia dall’1,3-bisfosfoglicerato all’ADP, con formazione di ATP e 3-fosfoglicerato.
Questa architettura di reazioni accoppiate illustra come gli enzimi orchestrino il flusso energetico: l’ossidazione controllata dell’aldeide viene temporaneamente “immagazzinata” in un legame ad alta energia e immediatamente convertita in lavoro chimico utile sotto forma di ATP e di equivalenti riducenti (NADH). In tal modo, la via glicolitica bilancia in modo efficiente trasferimenti di gruppi e scambi redox, sostenendo sia il fabbisogno energetico immediato sia l’alimentazione delle vie ossidative a valle.
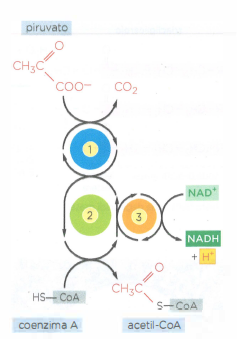
Nelle cellule eucariotiche in condizioni aerobiche, il piruvato generato dalla glicolisi viene importato nella matrice mitocondriale tramite il trasportatore specifico della membrana interna (Figura 05.09-03). Qui, un complesso multienzimatico di grandi dimensioni, il complesso piruvato deidrogenasi (PDH), ne catalizza la decarbossilazione ossidativa, producendo CO₂, NADH e acetil‑CoA (Figura 05.09-10). La reazione globale può essere rappresentata come \( \text{piruvato} + \text{CoA} + \text{NAD}^+ \rightarrow \text{acetil‑CoA} + \text{CO}_2 + \text{NADH} + \text{H}^+ \). Il gruppo acetile trasferito al coenzima A (CoA) costituisce il punto d’ingresso principale al metabolismo ossidativo del carbonio;
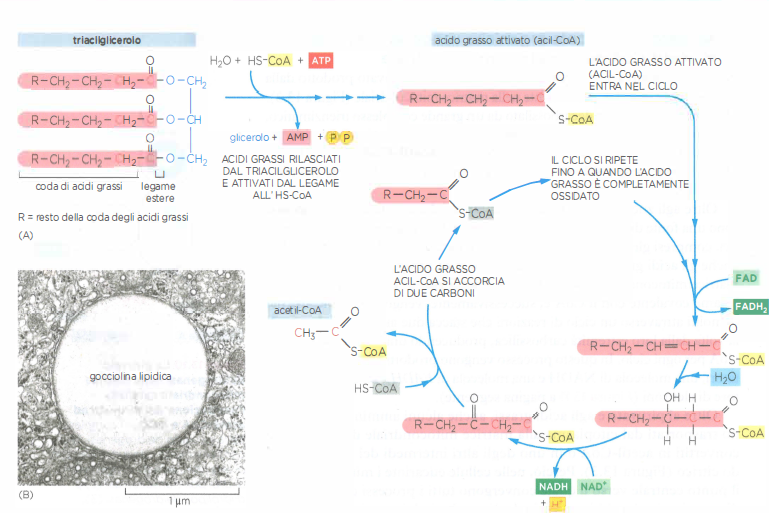
Nei viventi non fotosintetici, inclusi gli esseri umani, i lipidi rappresentano un’importante riserva energetica. Gli acidi grassi, una volta attivati a acil‑CoA nel citosol, vengono veicolati nella matrice tramite il sistema della carnitina e degradati sequenzialmente per β‑ossidazione: a ogni ciclo si rimuovono due atomi di carbonio dall’estremità carbossilica generando una molecola di acetil‑CoA, insieme a una molecola di NADH e una di FADH₂ (Figura 05.09-11). In parallelo, una quota di amminoacidi è trasferita dal citosol ai mitocondri, dove le relative vie di deaminazione e transaminazione li convogliano in acetil‑CoA o in intermedi del ciclo dell’acido citrico (Figura 05.09-03);
Questa convergenza fa dei mitocondri il nodo centrale del metabolismo energetico eucariotico, a prescindere che il carbonio derivi da zuccheri, lipidi o proteine. Nei batteri aerobi, privi di mitocondri, glicolisi, formazione di acetil‑CoA e reazioni del ciclo dell’acido citrico si svolgono nel citoplasma, mentre la catena di trasporto degli elettroni è localizzata nella membrana plasmatica;
Il catabolismo non si arresta all’acetil‑CoA: nella conversione delle molecole alimentari fino a questo intermedio si recupera solo una frazione dell’energia sotto forma di ATP, NADH e FADH₂, mentre la porzione maggiore rimane nel legame tioestere dell’acetil‑CoA. Lo stadio successivo, il ciclo dell’acido citrico, ossiderà completamente il gruppo acetile a CO₂ all’interno della matrice mitocondriale:
- Fonti principali di acetil‑CoA nella matrice: piruvato di origine glicolitica;
- acidi grassi attivati e importati tramite la navetta della carnitina;
- amminoacidi che confluiscono in acetil‑CoA o in intermedi del ciclo.
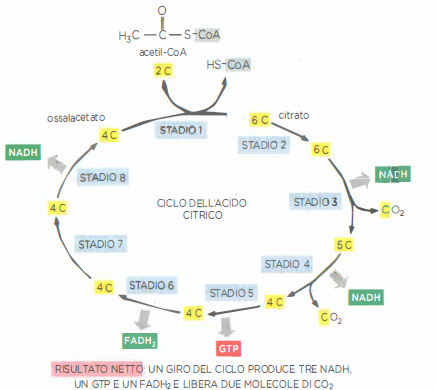
Nella matrice mitocondriale, il gruppo acetile dell’acetil‑CoA non viene ossidato direttamente, ma è dapprima condensato con l’ossalacetato a quattro atomi di carbonio per formare citrato, un acido tricarbossilico a sei atomi di carbonio, che dà il nome alla via. La successiva sequenza di otto reazioni riconverte il citrato in ossalacetato, completando un ciclo catalitico (Figura 05.09-12). L’ossidazione graduale del carbonio acetilico libera energia, immagazzinata prevalentemente nei trasportatori ridotti NADH e FADH₂, in analogia al principio visto per la glicolisi;
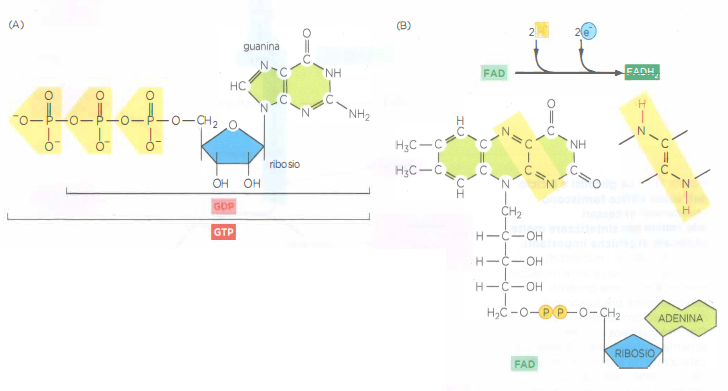
Sebbene nessuna tappa del ciclo utilizzi direttamente O₂, la via è strettamente dipendente dalla disponibilità di O₂, poiché solo la catena di trasporto degli elettroni può riossidare NADH e FADH₂ a NAD⁺ e FAD, indispensabili per il proseguimento del ciclo. In termini globali, la stechiometria per un turno è ben approssimata da: \[ \text{acetil‑CoA} + 3\,\text{NAD}^+ + \text{FAD} + \text{GDP} + \text{P}_\text{i} + 3\,\text{H}_2\text{O} \rightarrow 2\,\text{CO}_2 + 3\,\text{NADH} + \text{FADH}_2 + \text{GTP} + \text{CoA} + 3\,\text{H}^+ . \] Ogni giro fornisce dunque tre NADH, un FADH₂ e una molecola di GTP, che può trasferire il suo fosfato all’ADP formando ATP per azione della nucleoside‑difosfato chinasi (Figura 05.09-13);
È diffusa l’idea errata che l’ossigeno atmosferico “diventi” la CO₂ espirata. In realtà, gli atomi di ossigeno della CO₂ prodotta nel ciclo provengono dall’acqua: a ogni turno vengono consumate tre molecole di H₂O, i cui ossigeni si ritrovano nella CO₂ rilasciata. Le molecole di O₂ inalate, invece, accettano elettroni alla fine della catena respiratoria e sono ridotte a H₂O;
Dal punto di vista regolatorio, il flusso attraverso la via è sensibile allo stato energetico: NADH e ATP inibiscono varie tappe chiave (per esempio citrato sintasi, isocitrato deidrogenasi e α‑cheto-glutarato deidrogenasi), mentre ADP e Ca²⁺ ne favoriscono l’attività in tessuti ad alta richiesta energetica. Le origini evolutive del ciclo, comune a tutti gli organismi aerobi, si collocano verosimilmente dopo l’aumento dell’O₂ atmosferico avvenuto circa 1–2 miliardi di anni fa, pur con antecedenti più antichi in reti metaboliche ancestrali.
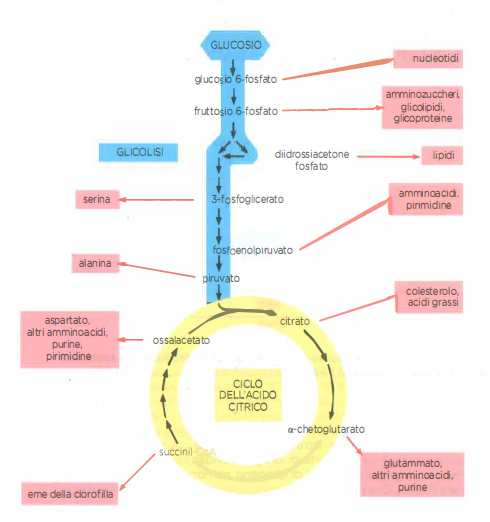
Oltre a generare energia, glicolisi e ciclo dell’acido citrico forniscono precursori carboniosi per numerose vie anaboliche. Intermedi centrali vengono “dirottati” verso la sintesi di amminoacidi, nucleotidi, lipidi e altre piccole molecole mediante reazioni enzimatiche specifiche. Per esempio, ossalacetato e α‑cheto-glutarato, prodotti del ciclo, attraversano la membrana mitocondriale e nel citosol fungono da precursori rispettivamente di aspartato e glutammato tramite transaminazione (Figura 05.09-14);
Analogamente, intermedi glicolitici come il 3‑fosfoglicerato alimentano la sintesi della serina, il piruvato quella dell’alanina, mentre il diidrossiacetone fosfato è alla base della formazione del glicerolo‑3‑fosfato per i glicerofosfolipidi. Il citrato esportato può essere riconvertito a acetil‑CoA nel citosol tramite l’ATP‑citrato liasi, fornendo unità acetiliche per la biosintesi degli acidi grassi e dell’ossalacetato per le vie anaplerotiche. Per preservare la capacità ossidativa del ciclo quando gli intermedi vengono sottratti alle biosintesi, le cellule impiegano reazioni anaplerotiche, tra cui la carbossilazione del piruvato a ossalacetato catalizzata dalla piruvato carbossilasi:
- Intermedi catabolici come piattaforme anaboliche: transaminazioni da α‑chetoacidi a amminoacidi;
- esportazione di citrato per la generazione citosolica di acetil‑CoA destinato alla lipogenesi;
- rifornimento anaplerotico del ciclo per sostenere sia ossidazione sia biosintesi;
- integrazione con la via dei pentoso fosfati per nucleotide e cofattori riducenti.
La rete emergente, schematizzata nella (Figura 05.09-14), evidenzia come la cellula bilanci dinamicamente domanda energetica e fabbisogno di precursori molecolari.
Nello stadio finale del catabolismo ossidativo, la fosforilazione ossidativa, l’energia chimica immagazzinata in NADH e FADH₂ viene convertita in ATP. Questi trasportatori cedono i loro elettroni alla catena di trasporto degli elettroni localizzata nella membrana mitocondriale interna (nei batteri aerobi, nella membrana plasmatica). Il flusso elettronico verso accettori progressivamente a potenziale redox più alto è accoppiato al pompaggio di protoni dalla matrice verso lo spazio intermembrana in siti specifici della catena (Figura 05.09-02), generando una forza proton‑motrice \( \Delta p \), somma del gradiente elettrico e di pH: \[ \Delta p = \Delta \psi - \frac{2{,}303\,RT}{F}\,\Delta \text{pH}. \] L’enzima ATP sintasi utilizza \( \Delta p \) per catalizzare la fosforilazione dell’ADP a ATP sulla faccia matriciale della membrana interna (Figura 05.09-15);
Al termine della catena, gli elettroni vengono trasferiti all’O₂ diffuso nei mitocondri, riducendolo a H₂O mediante combinazione con protoni della soluzione (Figura 05.09-15). A questo punto, l’energia estraibile dal substrato è stata praticamente interamente recuperata. La resa complessiva dell’ossidazione completa del glucosio a CO₂ e H₂O è di circa 30 molecole di ATP per molecola di glucosio, a confronto delle sole due molecole di ATP generate direttamente dalla glicolisi. La fosforilazione ossidativa opera sia in eucarioti sia in batteri aerobi e rappresenta una conquista fondamentale dell’evoluzione cellulare, alla base dell’elevata efficienza energetica dei sistemi viventi.