I virus possono replicarsi solo all’interno di una cellula ospite
Definizione
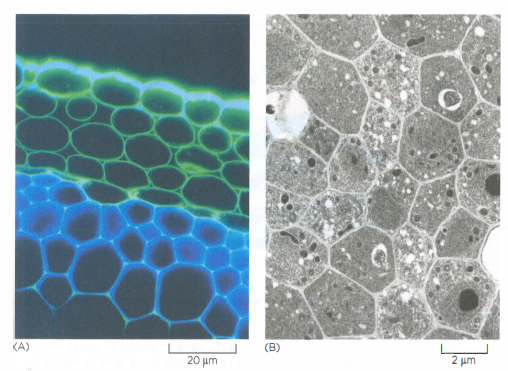
Tradizionalmente si distinguono quattro grandi categorie di tessuti animali: connettivo, epiteliale, nervoso e muscolare. Considerando l’architettura, tuttavia, la separazione fondamentale è tra i tessuti connettivi e tutti gli altri. Nei connettivi domina una matrice extracellulare abbondante, che assorbe e distribuisce i carichi meccanici; negli epiteli e in gran parte dei tessuti nervosi e muscolari, invece, la matrice è scarsa e la resistenza alle forze deriva principalmente dai contatti cellula-cellula e cellula-citoscheletro (Figura 06.02-01).
I tessuti connettivi offrono un repertorio morfologico e funzionale molto ampio. Possono essere (Figura 06.02-02):
- cordoniformi e flessibili, come i tendini, che trasmettono le forze muscolari alle ossa;
- lamellari e resistenti, come il derma, in cui la disposizione delle fibre favorisce la resistenza ai tagli;
- rigidi e minerali, come l’osso, dove la matrice è impregnata di cristalli di idrossiapatite;
- elastici e smorzanti, come la cartilagine, capace di distribuire i carichi compressivi nelle articolazioni;
- molli e trasparenti, come il corpo vitreo o la sostanza fondamentale di alcuni tessuti embrionali.
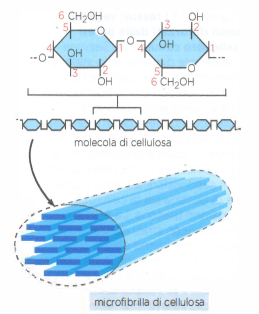
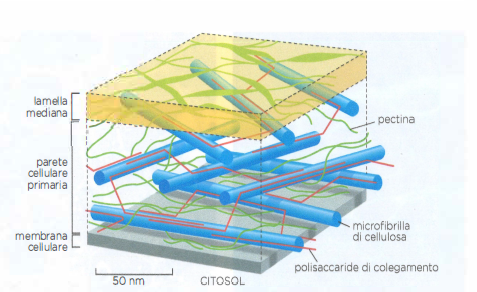
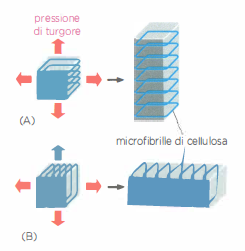
In tutti questi casi, il volume tissutale è occupato per lo più da matrice extracellulare; le cellule che la sintetizzano sono disperse come “isole” all’interno del materiale interstiziale, come illustrato in (Figura 06.02-06). A differenza dei vegetali, in cui il sostegno deriva principalmente da polisaccaridi strutturali, nei metazoi la resistenza meccanica è affidata a proteine fibrose, con il collagene in posizione preminente. Le proprietà specifiche dei diversi connettivi dipendono dal tipo di collagene, dalla sua abbondanza e, soprattutto, dall’interazione del collagene con altre componenti della matrice (Figura 06.02-03).
Tra le molecole che modulano la funzione meccanica spiccano:
- l’elastina, una proteina reticolata che conferisce capacità di ritorno elastico a tessuti sottoposti a deformazioni cicliche, come le pareti arteriose;
- i glicosaminoglicani e i proteoglicani, che formano gel idratati in grado di resistere alle compressioni e di regolare la diffusione di soluti;
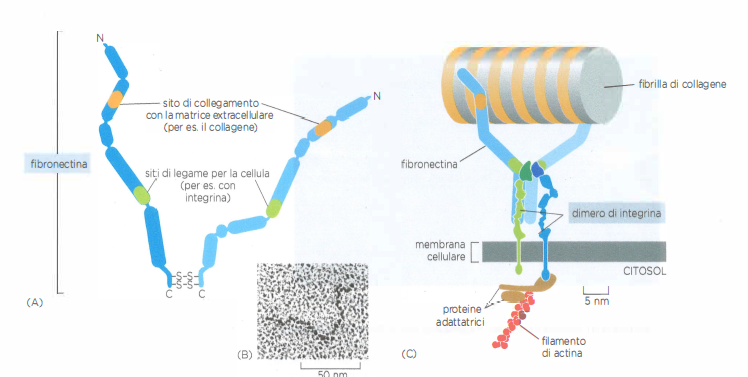
- proteine adesive come fibronectina e laminine, che organizzano l’assemblaggio della matrice e mediano l’ancoraggio delle cellule tramite integrine.
Il collagene è ubiquitario nel regno animale e comprende una famiglia numerosa di varianti. Nei mammiferi sono presenti decine di geni COL; nell’uomo si riconoscono 28 tipi di collagene distinti codificati da circa 45 geni. I collageni rappresentano le proteine strutturali dominanti in tendini, osso e cute (il cuoio è collagene trattato mediante concia) e costituiscono fino al 25% della massa proteica totale dell’adulto. Il collagene di tipo I è il più abbondante, arrivando a coprire circa il 90% del collagene corporeo (Figura 06.02-04).
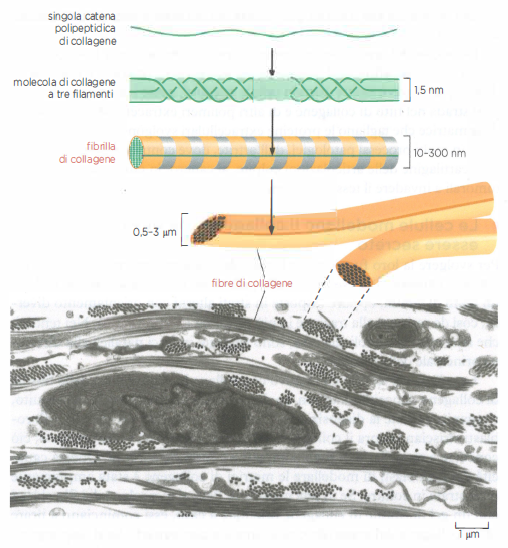
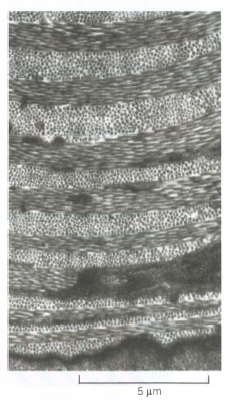
La singola molecola di collagene (tropocollagene) è formata da tre catene polipeptidiche che si avvolgono in una tripla elica, stabilizzata dalla presenza ripetuta del motivo Gly–X–Y, in cui X e Y sono spesso prolina e idrossiprolina. La idrossilazione di prolina e lisina, dipendente da vitamina C, rigidifica la tripla elica; deficit di questa modificazione riducono la stabilità del collagene. Le molecole, una volta secrete, si dispongono in modo ordinato formando fibrille di collagene, filamenti di diametro compreso tra 10–300 nm e lunghi più micrometri, che possono ulteriormente aggregarsi in fibre più spesse (Figura 06.02-07). I legami crociati covalenti, catalizzati da lisil ossidasi, incrementano la resistenza alla trazione. Altri collageni non fibrillari (ad esempio i tipi di rete) si localizzano alla superficie delle fibrille o nelle lamine basali, collegandole tra loro e con ulteriori componenti della matrice (Figura 06.02-05).
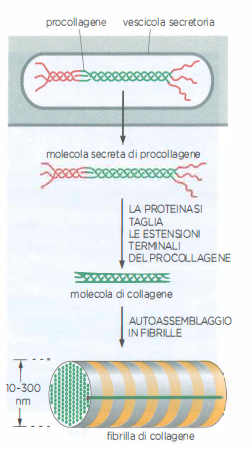
Le cellule stromali che vivono nella matrice e la sintetizzano prendono nomi diversi secondo il distretto: fibroblasti nella cute, nei tendini e in molti connettivi lassi e densi (Figura 06.02-07); osteoblasti nel tessuto osseo; condroblasti nella cartilagine. Queste cellule producono collagene e altre macromolecole della matrice attraverso il reticolo endoplasmatico rugoso e l’apparato di Golgi, e le rilasciano per esocitosi. Per evitare che le molecole si aggreghino prematuramente all’interno della cellula, il collagene viene sintetizzato come procollagene, che possiede propeptidi terminali N- e C- che impediscono l’assemblaggio in fibrille. Nel compartimento extracellulare tali propeptidi vengono rimossi da specifiche procollagene-proteinasi, consentendo alle molecole mature di auto-organizzarsi in fibrille (Figura 06.02-08). Proteine della superficie cellulare e della matrice, come la fibronectina, cooperano nel dirigere l’allineamento e la polimerizzazione delle fibrille lungo le linee di forza generate dalle cellule.
Alterazioni genetiche nei geni del procollagene o nelle proteinasi che rimuovono i propeptidi ostacolano la corretta fibrillogenesi, riducendo la resistenza alla trazione e aumentando l’estensibilità dei tessuti (Figura 06.02-09). Alcune forme della sindrome di Ehlers-Danlos ne sono un esempio clinico, con cute iperestensibile e fragilità dei legamenti; difetti in altre catene possono invece compromettere osso e dentina, come nelle osteogenesi imperfette.
La matrice extracellulare è dinamica: deve potersi rimodellare per permettere crescita, riparazione e rinnovamento dei tessuti, nonché la migrazione di cellule come macrofagi e fibroblasti attivati. La degradazione controllata delle proteine extracellulari è mediata da famiglie di proteasi tra cui:
- metalloproteinasi della matrice (MMP), capaci di tagliare collagene fibrillare, gelatine e proteoglicani;
- serin-proteasi e cistein-proteasi, inclusi membri della famiglia delle catepsine, attive in ambienti pericellulari e lisosomiali;
- ADAM e ADAMTS, coinvolte nella maturazione del procollagene e nel clivaggio di proteoglicani.
L’attività proteolitica è finemente regolata da inibitori endogeni, come i TIMP per le MMP, per evitare una eccessiva demolizione della matrice. Squilibri in questo sistema partecipano a molte condizioni patologiche: nelle artropatie degenerative l’eccesso di proteolisi contribuisce alla perdita di cartilagine articolare; in oncologia, la proteolisi pericellulare facilita l’invasione delle cellule tumorali attraverso il connettivo e la formazione di metastasi.
Perché le fibrille di collagene svolgano correttamente la loro funzione meccanica, la loro architettura deve essere ordinata e coerente con i carichi applicati. Nella cute, le fibrille si intrecciano con una disposizione simile a un tessuto intrecciato o si organizzano in lamelle sovrapposte con orientamento alternato, così da opporre resistenza alla trazione lungo più assi (Figura 06.02-10). Nei tendini, che trasmettono la forza dal muscolo all’osso, prevalgono fasci di fibrille allineati pressoché parallelamente alla direzione di trazione principale.
Le cellule del tessuto connettivo, in primis i fibroblasti, dirigono tale ordine depositando collagene con un orientamento preferenziale e rimodellandolo in seguito. Durante l’istogenesi, i fibroblasti migrano sulla matrice di collagene di nuova sintesi e applicano forze di trazione che ne determinano compattazione e allineamento, favorendo la formazione di lamine compatte e di cordoni fibrosi. Queste dinamiche sono state dimostrate in coltura: se si incorpora un numero controllato di fibroblasti in un gel di collagene con fibrille distribuite casualmente, le cellule generano trazione e “tirano” il collagene dal circostante, producendo fasci densi e orientati. Analogamente, collocando due piccoli espianti di tessuto embrionale ricchi di fibroblasti a distanza definita all’interno di un gel di collagene, il collagene interposto si riorganizza in una banda compatta di fibre allineate che collega i due espianti, fungendo da “ponte” (Figura 06.02-11). I fibroblasti migrano quindi lungo questa banda, seguendo le fibre allineate, creando un circuito di reciproca dipendenza: le cellule orientano le fibrille, e le fibrille guidano a loro volta la traiettoria delle cellule.
È verosimile che processi analoghi operino in vivo, generando ordine su larga scala nella matrice extracellulare di tendini, legamenti e connettivo denso che avvolge e connette gli organi. In tali contesti, la rimodellazione dipende sia da forze cellulari sia da modificazioni biochimiche della matrice, tra cui l’ossidazione enzimatica dei residui lisinici da parte della lisil-ossidasi, che stabilizza i legami crociati tra fibrille, e l’azione coordinata di metalloproteasi (MMP) e dei loro inibitori (TIMP), che modulano l’assemblaggio e il rinnovamento delle fibrille. La migrazione e la contrazione dei fibroblasti, che possono differenziarsi in miofibroblasti sotto stimoli meccanici e biochimici, sono inoltre cruciali nella riparazione tissutale e nella cicatrizzazione, dove la corretta disposizione del collagene determina sia la resistenza sia l’elasticità finale della cicatrice.
Le cellule ancorano e “sentono” la matrice extracellulare (ECM) grazie a recettori transmembrana della famiglia delle integrine. Il dominio extracellulare delle integrine riconosce specifici ligandi della ECM, mentre le code citoplasmatiche si connettono al citoscheletro, in particolare ai filamenti di actina, tramite proteine adattatrici come talina, kindlina, vinculina e paxillina. Questo accoppiamento meccanico conferisce punti di attacco robusti: senza tale collegamento, la forza esercitata verrebbe scaricata sul solo doppio strato lipidico, con rischio di estrazione del recettore dalla membrana.
In molti contesti tissutali l’interazione fra cellula e fibrille collagene è mediata dalla fibronectina, proteina modulare della ECM che possiede domini in grado di legare sia il collagene sia siti riconosciuti dalle integrine, spesso contenenti il motivo RGD. In tal modo, la fibronectina funge da “ponte” tra fibrille collagene e integrine. Va notato che alcune integrine (per esempio, α1β1 e α2β1) possono riconoscere direttamente sequenze nel collagene; tuttavia, l’asse fibronectina–integrina rappresenta un paradigma funzionale particolarmente efficace e diffuso (Figura 06.02-12).
Il legame della porzione extracellulare di un’integrina a fibronectina stabilizza, sul versante citoplasmatico, l’ancoraggio ai filamenti di actina tramite i complessi di adesione. In queste strutture, l’integrina trasmette forze di trazione e segnali meccanochimici al citoscheletro, evitando che il recettore venga strappato dal bilayer. La dinamica di avanzamento cellulare in un tessuto dipende dalla formazione e dal distacco coordinato di questi punti di adesione alle due estremità della cellula: le nuove adesioni maturano all’avanguardia, mentre quelle posteriori si disassemblano, consentendo la traslocazione del corpo cellulare.
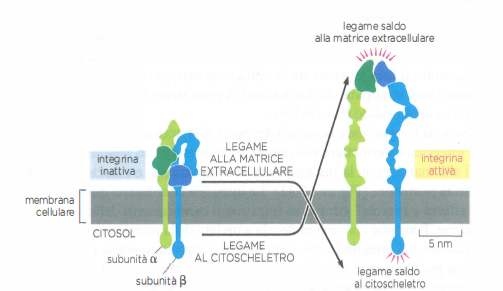
Le integrine sono recettori allosterici che attraversano stati conformazionali: da una conformazione “piegata” a bassa affinità a uno stato esteso e ad alta affinità. La modulazione può procedere dall’interno verso l’esterno (inside-out), quando segnali citoplasmatici reclutano talina/kindlina e “attivano” l’integrina, o dall’esterno verso l’interno (outside-in), quando il legame a un ligando della ECM innesca cascati di segnalazione con proteina chinasi associate alle code citoplasmatiche (Figura 06.02-13). Questi segnali regolano sopravvivenza, proliferazione e differenziamento, integrando input meccanici e biochimici.
Nel genoma umano sono presenti almeno 24 etero-dimeri integrinici, con specificità di ligando e funzioni dipendenti dal tipo cellulare. Alcuni esempi clinicamente rilevanti includono:
- Integrine β2 dei leucociti (per esempio, LFA-1/αLβ2), essenziali per l’adesione all’endotelio e la diapedesi; mutazioni in ITGB2 causano la sindrome da deficit di adesione dei leucociti di tipo I (LAD I), associata a infezioni ricorrenti e alterata risposta infiammatoria;
- Integrina piastrinica αIIbβ3, necessaria per l’aggregazione piastrinica tramite legame al fibrinogeno e alla fibronectina; difetti di questa integrina determinano la trombastenia di Glanzmann, con diatesi emorragica;
- Integrine α5β1 e αvβ3, coinvolte in adesione alla fibronectina e in processi di angiogenesi, migrazione e rimodellamento della ECM.
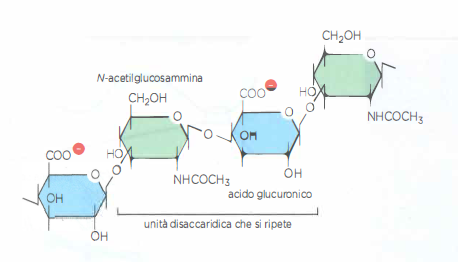
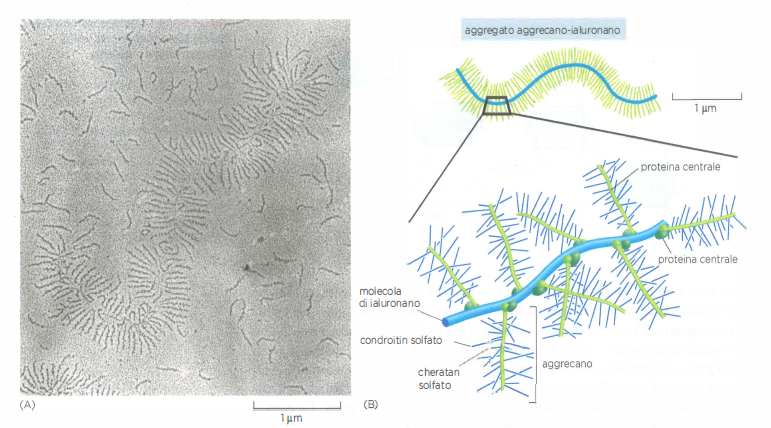
Se le fibrille di collagene conferiscono resistenza alla trazione, un insieme distinto di macromolecole della ECM fornisce il complemento meccanico: la resistenza alla compressione. Si tratta dei glicosamminoglicani (GAG), lunghe catene polisaccaridiche fortemente anioniche costituite da unità disaccaridiche ripetute (Figura 06.02-14). Nella matrice, i GAG sono per lo più legati covalentemente a proteine centrali formando proteoglicani, un gruppo estremamente eterogeneo per dimensioni, forma e proprietà chimiche. Tipicamente, molte catene GAG si inseriscono su una singola proteina core, che a sua volta può associare con il GAG libero ialuronano, generando complessi macromolecolari dalla struttura “a scovolino”. Nella cartilagine, l’aggrecano è particolarmente abbondante: oltre 100 catene GAG possono innestarsi su una proteina centrale, e molte di queste unità si associano allo ialuronano, attraverso proteine di collegamento, formando aggregati di massa molecolare di diversi milioni di dalton (Figura 06.02-15).
La proporzione relativa di GAG e collagene varia ampiamente tra i tessuti. Nei tendini e nell’osso predomina il collagene (nell’osso, mineralizzato con cristalli di fosfato di calcio), mentre i GAG sono presenti in quote più modeste. All’estremo opposto, l’umor vitreo dell’occhio è costituito quasi esclusivamente da ialuronano idratato, con quantità minime di collagene. A causa dell’elevata densità di cariche negative, i GAG adottano conformazioni estese e idratate, occupando grandi volumi rispetto alla massa e agendo come efficaci riempitivi della ECM (Figura 06.02-15).
I GAG formano gel idrofili anche a basse concentrazioni perché le cariche negative attraggono cationi, in particolare Na⁺, che, per effetto osmotico, richiamano acqua nella matrice. La pressione di rigonfiamento risultante può essere descritta in prima approssimazione come differenza di pressione osmotica tra il gel e il fluido esterno: \[ \Pi \approx R T \,\Delta C_{\text{ioni}} \] dove \(R\) è la costante dei gas, \(T\) la temperatura assoluta e \(\Delta C_{\text{ioni}}\) la differenza di concentrazione degli ioni mobili tra interno ed esterno. Ad esempio, un aumento di circa 50 mmol/L di ioni effettivi nel gel può generare una pressione osmotica dell’ordine di centinaia di kPa a temperatura fisiologica, sufficiente a espandere il reticolo idratato. Nelle matrici con elevate quantità di collagene intercalato ai proteoglicani, la tensione elastica delle fibrille controbilancia la pressione di turgore, producendo un materiale complesso robusto, resiliente e capace di dissipare energia. Queste proprietà emergenti sono evidenti nella cartilagine articolare, in grado di sostenere carichi compressivi pari a diverse centinaia di chilogrammi per centimetro quadrato durante attività come il salto o la corsa.
Oltre al ruolo meccanico e di idratazione, i proteoglicani svolgono funzioni regolatorie raffinate:
- Determinano porosità e carica del mezzo extracellulare, agendo da filtri che modulano la diffusione di soluti e macromolecole;
- Legano, proteggono o presentano fattori di crescita e chemochine, modulandone la disponibilità e il gradiente locale (per esempio, eparan solfato proteoglicani che sequestrano FGF);
- Regolano l’adesione e la migrazione cellulare fornendo piste di scorrimento o barriere, con effetti su polarità, velocità e direzionalità;
- Contribuiscono alla meccano-trasduzione, poiché le variazioni di idratazione e carico modificano lo stato conformazionale di complessi ECM–recettori di membrana, influenzando vie di segnalazione intracellulari.
In tal modo, i componenti della ECM influenzano profondamente il comportamento cellulare, spesso in un dialogo reciproco con le stesse cellule che li hanno prodotti. Molti aspetti dell’organizzazione su scala nanometrica e micrometrica di questi complessi, così come l’integrazione temporale dei segnali chimici e meccanici immessi nella matrice, rimangono oggetto di intensa ricerca.