Composti eterociclici aromatici
Definizione
Si definiscono eterociclici aromatici quei composti in cui l’anello aromatico contiene, al posto di uno o più atomi di carbonio, un eteroatomo (ad esempio azoto, ossigeno o zolfo). Per conservare l’aromaticità, l’anello deve essere ciclico, planare e completamente coniugato, con un numero di elettroni π che soddisfi la regola di Hückel \(4n+2\) (con \(n\in\mathbb{N}_0\)). La partecipazione o meno delle coppie di non legame dell’eteroatomo al sistema π è cruciale: tali coppie possono rimanere in un orbitale ibrido non coinvolto nella delocalizzazione, oppure contribuire alla conta elettronica del sestetto aromatico, con ricadute importanti sulle proprietà acido-base e sulla reattività.
Di seguito sono presentate formule di struttura e denominazioni correnti di alcuni eterocicli aromatici rappresentativi:
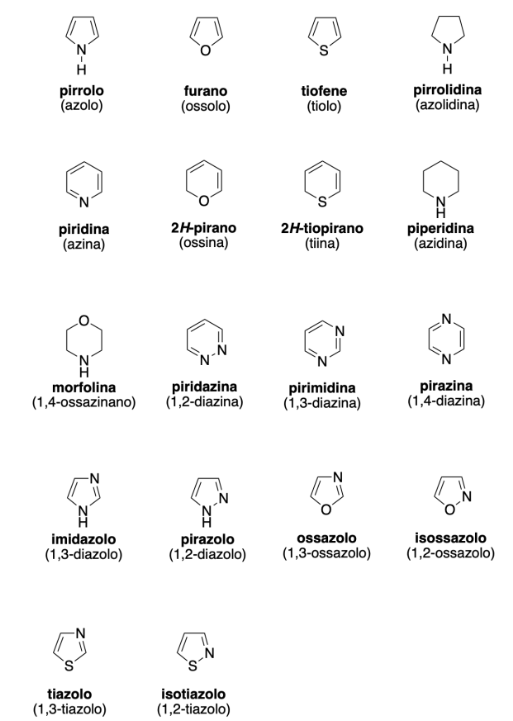 |
| Principali composti eterociclici aromatici. |
Piridina e pirimidina sono esempi di eterocicli benzenoidi in cui uno (piridina) o due (pirimidina) atomi dell’anello sono azoti sp2. In entrambe, la coppia solitaria dell’azoto si trova in un orbitale ibrido orientato al di fuori del sistema π, per cui non partecipa al sestetto aromatico. Tale configurazione rende questi centri potenziali accettori di protone: la piridina mostra una debole basicità (pKb intorno a 8,8), mentre la presenza di due azoti di tipo piridinico nella pirimidina, che impoveriscono densità elettronica sull’anello, riduce ulteriormente la basicità (pKb circa 13). In termini strutturali, l’anello resta planare e coniugato con 6 elettroni π provenienti dai tre doppi legami, confermando l’aromaticità.
Il pirrolo è un eterociclo a cinque termini con un azoto sp2 che porta un idrogeno. Qui la coppia di non legame dell’azoto è delocalizzata nel sistema π e contribuisce al conteggio elettronico: 4 elettroni π dai due doppi legami più 2 dall’azoto, per un totale di 6, soddisfacendo \(4n+2\) con \(n=1\). Di conseguenza, l’azoto non è disponibile come base di Lewis e la molecola nel complesso è non basica; per contro, il legame N–H può dare una debolissima acidità per effetto della differenza di elettronegatività tra N e H (pKa del pirrolo maggiore di 14), con dissociazione in H⁺ solo in condizioni fortemente basiche.
L’imidazolo presenta un anello pentatomico con due azoti non equivalenti: uno di tipo “pirrolico” (legato a H), la cui coppia solitaria è impegnata nel sistema π, e uno “piridinico”, la cui coppia non legante rimane disponibile e conferisce un debole carattere basico. Ne risulta un comportamento anfoterico: protonandosi preferenzialmente sull’azoto di tipo piridinico, l’imidazolo forma un catione stabilizzato per risonanza, con acidità della coniugata e basicità tali da renderlo efficace tampone vicino alla neutralità (pKa della forma coniugata intorno a 7,0). La delocalizzazione elettronica su tutto l’anello mantiene l’aromaticità anche nelle forme protonate più stabili.
Per chiarezza, si possono riassumere le relazioni struttura–proprietà dei principali anelli eterociclici aromatici come segue:
- pirimidina: due azoti piridinici rendono l’anello più povero di elettroni, abbassando la basicità rispetto alla piridina e disattivando l’anello verso sostituzione elettrofila aromatica;
- piridina: l’anello conserva 6 elettroni π dai doppi legami; la coppia dell’azoto è esterna al sistema π, con debole basicità e preferenza per reazioni di sostituzione elettrofila in posizione meta rispetto all’azoto;
- pirrolo: la coppia dell’azoto contribuisce al sestetto aromatico; l’anello è fortemente attivato verso sostituzione elettrofila, con attacco favorito in C-2, mentre la basicità è trascurabile e l’acidità N–H è debolissima;
- imidazolo: coesistenza di un centro debolmente acido (N–H) e di uno debolmente basico (N piridinico), con stabilizzazione per risonanza delle specie protonate e mantenimento dell’aromaticità.
Sia la stabilità sia il comportamento chimico di questi eterocicli sono coerenti con quelli del benzene, in particolare la predisposizione a reazioni di sostituzione rispetto a quelle di addizione, a tutela dell’aromaticità. Le loro proprietà determinano un’ampia diffusione in sistemi naturali e in composti bioattivi. Le purine e le pirimidine costituiscono le basi azotate dei nucleotidi, componenti di DNA (acido desossiribonucleico) e RNA (acido ribonucleico), molecole responsabili della conservazione e trasmissione dell’informazione genetica. L’anello piridinico ricorre, tra l’altro, nella nicotina e in numerosi cofattori enzimatici (per esempio, il nucleo piridinico del NAD⁺), mentre unità di tipo pirrolico si condensano a formare il macroanello porfirinico presente nell’emoglobina e nella clorofilla.
 |
| Strutture di risonanza della porfirina. |
Nel macroanello porfirinico, la coniugazione estesa e la planaritá consentono una marcata delocalizzazione elettronica, con conseguenze rilevanti sulle proprietà di coordinazione del metallo centrale (Fe nella protoporfirina IX dell’emoglobina, Mg nella clorofilla) e sulle transizioni elettroniche responsabili dell’assorbimento visibile.








