Composizione dell’atomo
Definizione
Per spiegare perché il ghiaccio resta a galla, perché acqua e olio non formano una miscela omogenea, o perché l’emoglobina cattura l’ossigeno ma viene bloccata dal monossido di carbonio, è necessario collegare i fenomeni osservabili alla scala microscopica della materia. Le proprietà collettive delle sostanze dipendono dalla struttura degli atomi e dal modo in cui essi si combinano in molecole e solidi. Le teorie sulla struttura atomica, sviluppate a partire dai primi esperimenti sulla natura elettrica della materia e sulla radioattività, consentono di interpretare il comportamento degli elementi e dei loro composti, come l’acqua o l’anidride carbonica, in termini di particelle costituenti e di configurazione elettronica.
Ogni elemento possiede una struttura atomica caratteristica che ne determina l’identità chimica. La legge periodica fornisce il principio organizzativo che mette in relazione struttura elettronica e proprietà chimico-fisiche, rendendo la tavola periodica una mappa predittiva del comportamento degli elementi. La disposizione periodica, oltre a guidare la previsione di reattività e stati di ossidazione, costituisce la base concettuale per comprendere il legame chimico e la formazione delle molecole. Le proprietà massive di solidi, liquidi e gas sono quindi radicate nelle proprietà degli atomi che li compongono.
L’unità fondamentale di un elemento è l’atomo, la porzione più piccola capace di conservarne l’identità chimica. Un frammento di alluminio talmente minuto da risultare invisibile contiene un numero astronomico di atomi disposti secondo strutture ordinate. Le dimensioni atomiche sono estremamente ridotte; dall’introduzione del microscopio a scansione a effetto tunnel (1981) è possibile ottenere immagini della disposizione di singoli atomi su superfici cristalline (Figura 01.06-01).
In certe condizioni, alcuni nuclei atomici si trasformano spontaneamente emettendo particelle e radiazione: è il decadimento radioattivo, che libera notevoli quantità di energia. Dal punto di vista chimico è però sufficiente considerare tre costituenti principali della materia ordinaria: elettroni, protoni e neutroni. Esistono altre particelle subatomiche (per esempio neutrini, quark e gluoni) rilevanti in fisica nucleare e delle particelle, ma non necessarie per la trattazione delle proprietà chimiche di base.
- Il nucleo, regione centrale piccola e densissima, possiede carica positiva ed è costituito da protoni (carichi positivamente) e neutroni (elettricamente neutri);
- Attorno al nucleo si estende una regione diffusa di carica negativa in cui si muovono gli elettroni, la cui massa è circa tremila volte inferiore a quella di un nucleone.
Le proprietà quantitative delle tre particelle (carica in multipli della carica elementare \(e\), massa in unità di massa atomica unificata, u) sono riassunte nella (Tabella 01.06-01). Indicativamente: \(m_p \approx 1,007\,\mathrm{u}\), \(m_n \approx 1,009\,\mathrm{u}\), \(m_e \approx 0,00055\,\mathrm{u}\); le cariche sono \(q_p = +1\), \(q_n = 0\), \(q_e = -1\). Poiché la massa elettronica è trascurabile rispetto a quella nucleare, la quasi totalità della massa atomica risiede nel nucleo.
L’identità di un elemento è determinata dal numero di protoni nel nucleo, detto numero atomico e indicato con \(Z\). La somma di protoni e neutroni fornisce il numero di massa \(A\):
\[ A = Z + N, \]
dove \(N\) è il numero di neutroni. Ne segue che
\[ N = A - Z. \]
Un atomo neutro possiede un numero di elettroni pari a \(Z\), in modo che la carica negativa degli elettroni bilanci esattamente la carica positiva del nucleo. La notazione nucleare compatta è \({}^{A}_{Z}\mathrm{X}\), dove X è il simbolo dell’elemento.
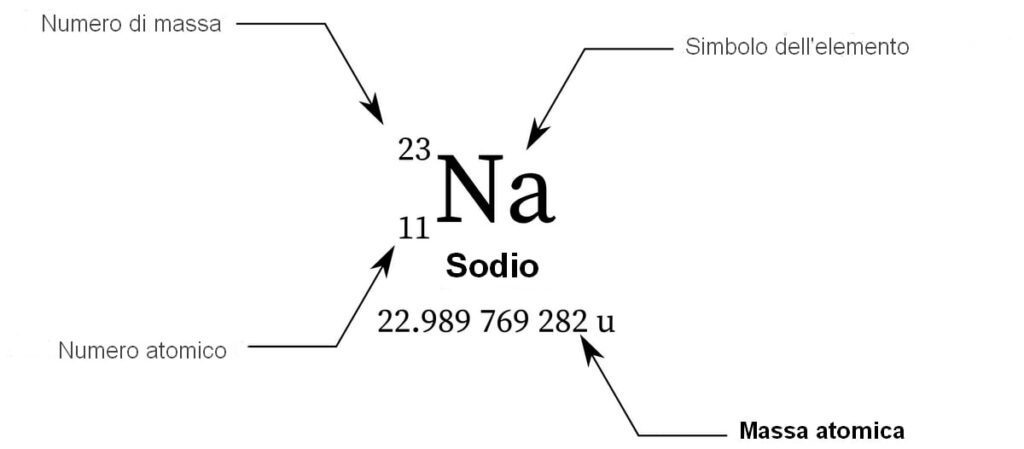 |
| Sodio – struttura dei dati fondamentali dell’elemento chimico |
Il numero atomico, dunque, fissa l’appartenenza dell’atomo a un elemento, mentre il numero di massa specifica quanti nucleoni contiene il singolo nucleo. Questa distinzione è cruciale per collegare i dati della tavola periodica con la composizione isotopica reale dei campioni.
| Particella | Carica | Massa (uma) | Massa (g) | Rilevanza biomedica |
|---|---|---|---|---|
| Elettrone (e⁻) | –1 | 5.4 × 10⁻⁴ | 9.1095 × 10⁻²⁸ | Coinvolto nelle reazioni redox e nei potenziali di membrana |
| Protone (p⁺) | +1 | 1.0 | 1.6725 × 10⁻²⁴ | Fondamentale per il pH e l’equilibrio acido-base |
| Neutrone (n) | 0 | 1.0 | 1.6750 × 10⁻²⁴ | Determina la stabilità del nucleo, importante nei processi radioattivi |
| Positrone (e⁺) | +1 | 5.4 × 10⁻⁴ | 9.1095 × 10⁻²⁸ | Antiparticella dell’elettrone, usata in diagnostica PET |
| Neutrino (ν) | 0 | ≈0 | ≈0 | Particella leggera, studiata in biofisica e nei decadimenti nucleari |
Caratteristiche delle particelle subatomiche
Principali proprietà delle tre particelle subatomiche fondamentali.
Gli isotopi sono nuclei dello stesso elemento (stesso \(Z\)) che differiscono per il numero di neutroni e quindi per il numero di massa \(A\). Il comportamento chimico è praticamente identico tra isotopi dello stesso elemento, poiché è controllato dagli elettroni; ciò che cambia è il comportamento nucleare, inclusa l’eventuale instabilità radioattiva.
 |
| Catena di idrocarburi – serie omologa degli alcani |
Per chiarezza si usa spesso la notazione nome-numero di massa, ad esempio “carbonio-12” o “C-12”, e “carbonio-14” o “C-14”.
 |
| Isotopi del carbonio – C-12, C-13 e C-14 |
Alcuni isotopi sono radioattivi e si trasformano in altri nuclei emettendo particelle (per esempio \(\alpha\), \(\beta\)) ed energia sotto forma di radiazione. Proprio grazie a questa caratteristica, gli isotopi radioattivi possono essere impiegati come traccianti, cioè come marcatori miscelati a specie non radioattive per seguirne il destino in sistemi chimici e biologici. Le reazioni chimiche non “distinguono” tra isotopi dello stesso elemento, ma gli strumenti analitici possono rintracciare la radiazione o, nel caso di isotopi stabili, la differenza di massa:
- studio dei cicli metabolici, monitorando il percorso di un nutriente marcato in un organismo;
- datazione di campioni geologici e archeologici tramite rapporti isotopici;
- tracciamento di inquinanti in ambienti naturali per identificarne la sorgente;
- diagnostica medica, ad esempio con radiofarmaci a emivita breve.
L’esistenza degli isotopi spiega perché le masse atomiche riportate nella tavola periodica non sono, in generale, numeri interi. La massa atomica tabulata è la media pesata delle masse isotopiche, con pesi pari alle abbondanze isotopiche naturali. È importante non confondere questa grandezza con il numero di massa \(A\), che è un intero riferito a un singolo isotopo.
Come esempio numerico, consideriamo il neon, che in natura presenta tre isotopi principali: Ne-20, Ne-21 e Ne-22. Indicando con \(m_i\) la massa dell’isotopo \(i\) e con \(x_i\) la corrispondente frazione di abbondanza, si ha
\[ \bar{m} = \sum_i x_i\, m_i. \]
Se assumiamo \(x_{20} = 0,9048\), \(x_{21} = 0,0027\), \(x_{22} = 0,0925\), con masse isotopiche approssimate \(m_{20} = 19,992\,\mathrm{u}\), \(m_{21} = 20,994\,\mathrm{u}\), \(m_{22} = 21,991\,\mathrm{u}\), otteniamo
\[ \bar{m} = (0,9048\times 19,992) + (0,0027\times 20,994) + (0,0925\times 21,991) \approx 20,180\,\mathrm{u}, \]
valore in accordo con quello riportato nelle tavole ufficiali. Campioni provenienti da fonti naturali differenti possono presentare lievi variazioni delle abbondanze isotopiche; per alcuni elementi, di conseguenza, gli intervalli di “pesi atomici standard” pubblicati dagli organismi internazionali riflettono tale variabilità.
In sintesi: dato un elemento con numero atomico \(Z\), i suoi isotopi condividono lo stesso numero di protoni ed elettroni (negli atomi neutri) ma differiscono nel numero di neutroni \(N\). Per ciascun isotopo vale \(A = Z + N\); il numero di neutroni è quindi \(N = A - Z\). La massa atomica riportata in tavola periodica è una media pesata delle masse isotopiche, non un intero, mentre il numero di massa si riferisce a un singolo nucleo specifico.









