Assorbimento della radiazione corpuscolare
Definizione
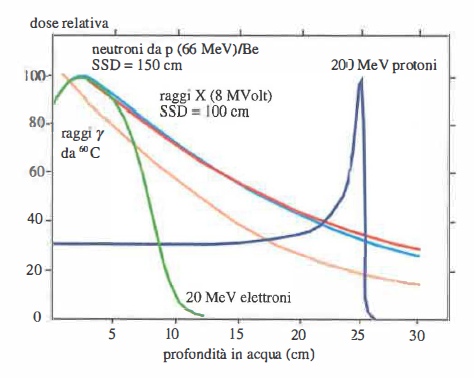
L’impiego sistematico dei raggi X a fini antitumorali prende avvio su vasta scala intorno al 1925. Oggi, oltre ai fotoni X o γ, trovano largo utilizzo anche fasci di elettroni (radiazioni β⁻), entrambi generati da acceleratori clinici dedicati. I protoni, per le loro peculiari modalità di cessione di energia alla materia (Figura 07.29-01), vennero proposti già nel 1946 come candidati ottimali per l’ablazione di tessuti neoplastici; tuttavia, soltanto con il progresso della tecnologia acceleratrice si sono potuti ottenere, a partire dagli anni ’90, fasci con caratteristiche geometriche, energetiche e dosimetriche adeguate alla pratica sanitaria. Negli ultimi anni si sono aggiunti anche fasci di ioni pesanti a scopo clinico.
La radioterapia sfrutta effetti deterministici prodotti da dosi elevate di radiazione ionizzante per indurre morte cellulare nei tessuti patologici. La sua efficacia dipende dal differente profilo di radiosensibilità tra cellule sane e cellule tumorali, legato al tipo cellulare, al microambiente e al ciclo cellulare. La dose terapeutica deve massimizzare la probabilità di controllo del tumore rimanendo, al contempo, al di sotto delle soglie di tossicità clinicamente rilevanti per gli organi sani adiacenti.
Per migliorare il rapporto terapeutico si ricorre al frazionamento della dose, che tiene conto di processi di riparazione del DNA, ridistribuzione nel ciclo cellulare, ripopolazione e riossigenazione dei tessuti. Inoltre, per limitare la dose ai volumi sani, si impiegano molteplici campi d’ingresso con differenti orientazioni, così da concentrare l’accumulo di dose nel bersaglio e ridurre il carico dosimetrico lungo i percorsi di entrata e uscita dei fasci.
Nel seguito si distinguono, in sintesi, le principali modalità di impiego: radioterapia “convenzionale” con fotoni X/γ, elettroni e radionuclidi, e l’adroterapia con protoni, neutroni e ioni pesanti. Questi ultimi, essendo soggetti all’interazione nucleare forte, rientrano nel novero degli adroni; al contrario, raggi X, γ ed elettroni interagiscono prevalentemente per via elettromagnetica.
La terapia con radiazioni comprende varie strategie operative. In ambito ginecologico, urologico e in altre sedi, si adottano sorgenti sigillate impiantabili (brachiterapia), quali semi o fili di radionuclidi (es. iridio o cesio), inseriti chirurgicamente nel volume tumorale per tempi programmati mediante sistemi di “afterloading” che consentono elevata precisione e sicurezza operativa.
I radionuclidi possono anche costituire sorgenti esterne: un esempio è il ⁶⁰Co, impiegato nella gamma knife, che emette fotoni γ a 1,17 MeV e 1,33 MeV focalizzati in un piccolo volume bersaglio, tecnica adottata in particolare per lesioni encefaliche (si veda oltre).
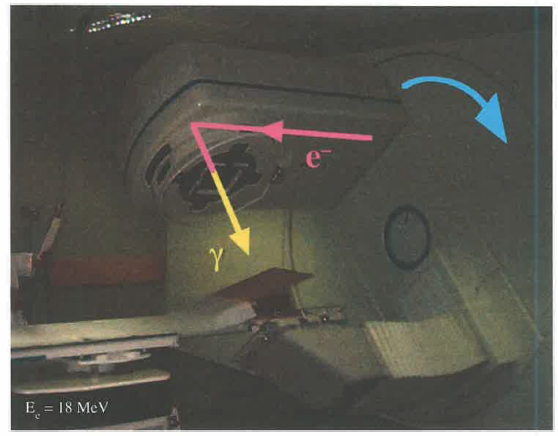
Gli acceleratori clinici (linac) forniscono fasci terapeutici di fotoni X ad alte energie nominali (tipicamente 6–18 MV) e fasci di elettroni con energie fino a circa 20 MeV. In (Figura 07.29-02) è rappresentato un acceleratore lineare in sala di trattamento. La tecnologia dei collimatori multilamellari, dei sistemi di guida-immagine e del controllo del movimento ha reso la deposizione di dose sempre più mirata e riproducibile.
Le principali metodiche di rilascio della dose in radioterapia con fotoni/elettroni includono:
- TBI (Total Body Irradiation): irradiazione dell’intero corpo per la soppressione del midollo ematopoietico, propedeutica al trapianto di cellule staminali;
- Gamma knife: convergenza di molteplici fasci γ, collimati e geometricamente focalizzati, su volumi bersaglio dell’ordine dei mm³; la collimazione è ottenuta con sistemi in piombo fissi o dinamici che selezionano traiettorie prefissate;
- Terapia conformazionale 3D: sagomatura del fascio mediante collimatori multilamellari e/o filtri, con uso di molteplici campi (anche più di cinque) per riprodurre la geometria del volume tumorale riducendo la dose agli organi a rischio;
- Terapia conformazionale 4D: estensione tempo-dipendente della 3D, con irradiazione sincronizzata con il movimento fisiologico (per esempio la respirazione), utile in particolare in sede toracica;
- IMRT (Intensity Modulated Radiation Therapy): modulazione spaziale dell’intensità di dose per adattare la distribuzione al profilo del bersaglio e ai vincoli dosimetrici degli organi critici. Si pianifica in modalità inversa, partendo dai limiti sugli organi a rischio e dagli obiettivi sul bersaglio, mediante software di ottimizzazione;
- IGRT (Image-Guided Radiation Therapy) e tecniche dinamiche: uso di immagini in sala (portali elettronici, cone-beam CT) per il riposizionamento quotidiano e, quando necessario, erogazioni continue o ad arco (ad es. VMAT) con controllo del movimento.
La pianificazione è fase cruciale e integra informazioni multimodali (radiografia, TC, ecografia, scintigrafia, PET, risonanza magnetica, ecc.) con i parametri tecnici della metodica scelta. Il risultato è un piano di trattamento (TPS, Treatment Planning System) definito dallo specialista in fisica medica, che include: dose totale, frazionamento (tipicamente circa 15 ÷ 25 frazioni distribuite in alcune settimane), numero e geometria dei campi, dispositivi di immobilizzazione e strategie di verifica. In genere ogni frazione ha una durata di erogazione dell’ordine di 90 ÷ 180 s, mentre il posizionamento e le verifiche preliminari possono richiedere 15 ÷ 30 minuti, spesso preceduti da una simulazione TC dedicata.
La verifica dell’esattezza del posizionamento e della distribuzione di dose può avvalersi di immagini portali acquisite durante il trattamento; oltre a pellicole dedicate, si usano diffusamente rivelatori elettronici a pannello piatto e cone-beam CT per controllare con maggiore accuratezza la corrispondenza tra piano e anatomia del giorno. La radioterapia può essere somministrata anche intraoperatoriamente (IORT, Intraoperative Radiation Therapy), utilizzando piccoli acceleratori mobili che erogano elettroni sul letto chirurgico immediatamente dopo l’asportazione tumorale, così da massimizzare la dose al residuo microscopico risparmiando i tessuti circostanti.
L’adroterapia, che impiega protoni e ioni pesanti, si è sviluppata clinicamente dagli anni ’90, inizialmente presso grandi laboratori di fisica nucleare e, in seguito, in centri dedicati nei quali un unico acceleratore alimenta più sale di trattamento. Gli adroni offrono vantaggi fisico-biologici rilevanti:
- a) Picco di Bragg: l’energia è rilasciata con un massimo nettamente definito in profondità, consentendo un risparmio sostanziale dei tessuti sani prossimali e distali rispetto al bersaglio (Figura 07.29-01);
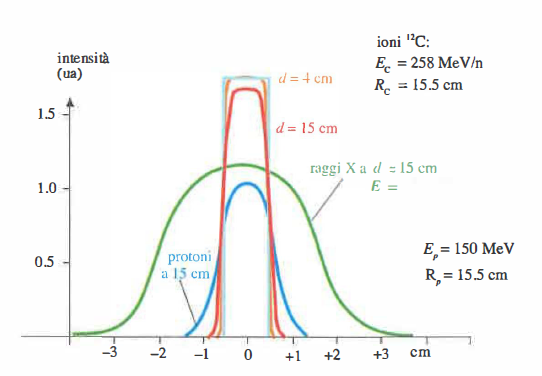
- b) Elevata collimazione e controllabilità spaziale: fasci stretti consentono deposizione millimetrica della dose (Figura 07.29-03). Lettini robotizzati, imaging in tempo reale e, se necessario, sistemi di gating respiratorio consentono di compensare il movimento del bersaglio;
- c) Qualità di radiazione: l’elevata densità di ionizzazione, specie per ioni pesanti, incrementa le rotture doppio filamento del DNA oltre agli effetti indiretti via radicali liberi, risultando efficace anche su neoplasie relativamente radioresistenti.
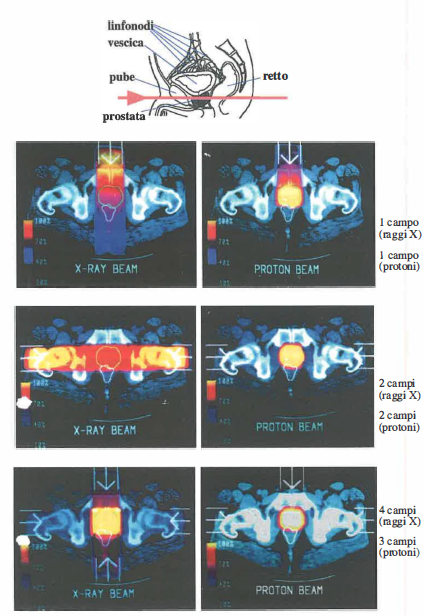
Queste proprietà, congiuntamente, accrescono il rapporto terapeutico, come suggerito dai confronti dosimetrici riportati in (Figura 07.29-04). Analogamente alla foton-terapia, anche l’adroterapia richiede un’accurata pianificazione (TPS) e, grazie alla maggiore selettività spaziale, può essere completata in un numero più contenuto di frazioni rispetto alla radioterapia convenzionale (Figura 07.29-04).
Alcuni aspetti fisico-biologici meritano una menzione specifica:
- Modello lineare‑quadratico: la sopravvivenza clonogenica è descritta da \( S(D) = \exp(-\alpha D - \beta D^{2}) \). La biologically effective dose si esprime come \( \mathrm{BED} = n d \left(1 + \frac{d}{\alpha/\beta}\right) \), dove n è il numero di frazioni e d la dose per frazione;
- LET, RBE e OER: l’efficacia biologica relativa (RBE) dei protoni è in media circa 1,1, mentre per ioni carbonio può raggiungere valori intorno a 2–3, con riduzione del rapporto di potenziamento da ossigeno (OER) e potenziale vantaggio in condizioni ipossiche;
- Pianificazione con protoni/ioni: la creazione di un “SOBP” (Spread-Out Bragg Peak) combina contributi a diverse gamme energetiche per coprire l’intero volume bersaglio. Si utilizzano tecniche di scattering passivo o di “pencil beam scanning”; la gestione delle incertezze di range (eterogeneità tessutali, conversione HU‑densità) richiede approcci di “robust planning” e strategie di controllo del movimento;
- Gestione del movimento: nelle sedi toraco‑addominali si adottano gating, breath-hold o tracking per mitigare l’interplay tra scansione del fascio e spostamenti del bersaglio.
La pratica clinica si fonda su un bilanciamento attento tra efficacia antitumorale e protezione tissutale. In particolare, la delimitazione del bersaglio segue convenzioni internazionali (GTV, CTV, PTV) e integra imaging multimodale per ridurre le incertezze geometriche. La disponibilità di sistemi di verifica in sala, la standardizzazione dei flussi (dalla simulazione TC all’erogazione) e il controllo qualità continuo degli acceleratori e dei rivelatori sono condizioni essenziali per l’affidabilità della cura.
Nel complesso, l’evoluzione tecnologica di acceleratori, collimazione, imaging e calcolo numerico ha permesso terapie più selettive e personalizzate, nelle quali la scelta tra fotoni, elettroni, protoni o ioni dipende da sede, istologia, vicinanza di organi a rischio, obiettivi clinici e disponibilità delle risorse. L’adozione di metodiche avanzate, dall’IMRT all’adroterapia, si inserisce in una strategia di ottimizzazione dosimetrica e biologica volta a incrementare la probabilità di controllo locale mantenendo contenuta la morbidità acuta e tardiva.