Forze di coesione e tensione superficiale
Definizione
Nell’immaginario comune la trazione fino a rottura evoca i solidi, come discusso nel Capitolo 4; eppure anche i liquidi oppongono resistenza alla separazione. Un esempio classico è l’acqua pura, priva di bolle d’aria, confinata tra due lastre levigate: per allontanare i piani occorre una forza considerevole. Nella statica dei fluidi si deve quindi considerare l’azione di forze peculiari agenti alla superficie libera, riconducibili alla coesione molecolare del liquido. Nei solidi tali interazioni mantengono le molecole in posizioni sostanzialmente fisse (con piccole oscillazioni attorno all’equilibrio), garantendo forma e volume propri. Nei gas, al contrario, le forze coesive sono debolissime: le molecole percorrono tratti quasi rettilinei finché urtano tra loro o con le pareti, assumendo forma e volume del recipiente. I liquidi si collocano in posizione intermedia: la coesione è sufficiente a mantenere le molecole ravvicinate, ma permette loro di scambiarsi posizione; le molecole prossime all’interfaccia possono inoltre sfuggire allo stato liquido e passare in vapore. Un liquido ha volume proprio, ma adotta la forma del contenitore; tuttavia, per effetto delle forze coesive, la sua superficie libera può comportarsi come se avesse una “forma preferita”.
Osservazioni sperimentali mostrano che un liquido tende a configurarsi minimizzando l’area della propria superficie libera. Ne sono esempi la prossima sfericità di piccole bolle di sapone o di minute goccioline di mercurio su un piano pulito: la sfera è infatti la configurazione di area minima a parità di volume. Un’altra evidenza quotidiana è la possibilità di adagiare con cura una graffetta metallica su acqua perfettamente quieta senza che affondi: la superficie si comporta come una pellicola tesa capace di sostenere oggetti leggeri.
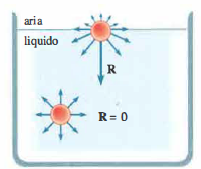
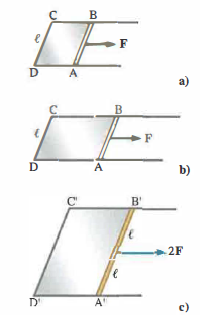
Per chiarire perché le interazioni coesive si manifestano in modo peculiare alla superficie, consideriamo una molecola immersa nel bulk del liquido (Figura 03.06-01): le forze esercitate dalle molecole circostanti, essendo distribuite simmetricamente, hanno risultante nulla. Una molecola prossima all’interfaccia, invece, sperimenta una risultante diretta verso l’interno per deficit di vicini dal lato della fase esterna. Ne consegue che aumentare l’area della superficie libera richiede lavoro: bisogna trasferire molecole dall’interno alla superficie vincendo la coesione. In accordo con il principio di equilibrio meccanico — un sistema tende a configurazioni di energia potenziale minima — la superficie libera si comporta come una membrana tesa, interessata da forze tangenziali che tendono a contrarla. Tali forze agiscono perpendicolarmente al contorno e, sperimentalmente, la forza per unità di lunghezza lungo un bordo è indipendente dall’estensione dell’area che racchiude (Figura 03.06-02). Si introduce pertanto il coefficiente di tensione superficiale τ come forza per unità di lunghezza lungo il bordo della lamina liquida:
\[ \tau = \frac{F}{\ell} \]
dove
\[ \ell \]
è la lunghezza del bordo per una singola superficie libera, e il suo doppio nel caso di una lamina con due facce esposte; F è detta forza di tensione superficiale. Una formulazione energetica è equivalente: l’incremento di area di una superficie libera (o delle due facce di una lamina) di ΔS richiede un lavoro L contro le forze superficiali, per cui si definisce τ come lavoro per unità di area creata:
\[ \tau = \frac{L}{|\Delta S|} \]
Nel Sistema Internazionale l’unità di misura è il newton/metro (N/m), equivalente a joule/metro quadrato (J/m²), mentre nel sistema C.G.S. si usa la dyna/cm; vale 1 N/m = 10³ dyna/cm.
Dalla (\tau = \frac{L}{|\Delta S|}), se Sᵢ indica l’area iniziale e S_f quella finale, il lavoro svolto dalle forze di tensione superficiale nel riportare la superficie da S_f a Sᵢ dipende solo dagli stati iniziale e finale:
\[ L = \tau (S_i - S_f), \]
In analogia con le forze conservative in Meccanica, si può introdurre un’energia potenziale associata all’interfaccia:
\[ U = -\tau S, \] da intendersi a meno di una costante additiva e con il segno fissato dalla convenzione adottata; in termini pratici, l’energia libera superficiale cresce con l’area, il che giustifica la naturale tendenza alla minimizzazione di S.
Quando il liquido è a contatto con un gas, un altro liquido o un solido, oltre alle forze di coesione tra molecole dello stesso liquido agiscono forze attrattive tra specie diverse, dette forze di adesione. Poiché la risultante R sulle molecole prossime alla superficie (Figura 03.06-01) dipende anche dall’adesione, il valore di τ all’interfaccia risulta funzione della natura di entrambe le fasi. La (Tabella 03.06-01) riporta alcuni valori indicativi della tensione superficiale per diverse coppie di mezzi. In sintesi, per effetto congiunto di coesione e adesione — la cui risultante è normale alla superficie e diretta verso l’interno del liquido — compare lungo la superficie libera (o di contatto) una forza tangenziale di contrazione, la tensione superficiale.
Molti fenomeni di uso comune dipendono da τ. La capacità bagnante di un liquido, cruciale nella detergenza, aumenta al diminuire della tensione superficiale: una soluzione a bassa τ si distende con maggiore facilità sulla superficie da pulire. La presenza di tensioattivi, come saponi e detersivi, riduce τ e favorisce la rimozione dello sporco. Anche la temperatura influenza marcatamente la tensione superficiale: tipicamente τ diminuisce all’aumentare della temperatura perché l’agitazione termica indebolisce l’effetto medio delle forze coesive; ciò spiega perché l’acqua calda risulti più efficace nel lavaggio rispetto a quella fredda. In prima approssimazione empirica, la dipendenza da t (in °C) può essere descritta da:
\[ \tau = \tau_{0} \left( 1 - \frac{t}{T_{c}} \right)^{n}, \] dove τ₀ è la tensione superficiale alla temperatura di 0 °C, T_c è la temperatura critica del liquido e in molti casi l’esponente n è prossimo a 1,2. La tensione tende a annullarsi in prossimità di T_c, coerentemente con il fatto che al punto critico scompare la distinzione tra fase liquida e gassosa.
La relazione tra tensione superficiale e attività biologica o chimica è documentata anche per i disinfettanti: a parità di altre proprietà, un disinfettante liquido è spesso più efficace quanto più bassa è la sua τ, in quanto migliora la bagnabilità e il contatto con i microrganismi.
Fattori che determinano il valore di τ all’interfaccia comprendono:
- la natura chimico-fisica delle due fasi a contatto e l’intensità relativa di coesione e adesione;
- la temperatura e, per soluzioni, la presenza di soluti o tensioattivi che possono adsorbire all’interfaccia;
- lo stato di purezza e le eventuali impurità superficiali, che spesso agiscono anche in tracce.
Ritornando al fenomeno del “falso galleggiamento” di piccoli oggetti, si noti che essi sono sostenuti non dalla spinta di Archimede ma dalla risultante delle forze superficiali bilanciata dal peso: la superficie dell’acqua si deforma elasticamente, generando una componente verticale della tensione in grado di sorreggere corpi sufficientemente piccoli e idrofobici. Analoghi ragionamenti interpretano la stabilità di sottili pellicole liquide e la forma pressoché sferica di piccole gocce visibili su superfici superidrofobiche.
| Interfaccia | τ (dyne/cm) | Nota |
|---|---|---|
| Mercurio – aria | 476.0 | Valore estremamente elevato, usato come confronto in studi di fisica dei fluidi. |
| Acqua – aria | 72.5 | Riferimento fondamentale; influenza la formazione di gocce e alveoli polmonari. |
| Benzene – aria | 28.9 | Fluido organico con bassa tensione superficiale. |
| Cloroformio – aria | 26.8 | Solvente organico, usato come confronto sperimentale. |
| Etere – aria | 17.0 | Liquido molto volatile, tensione superficiale ridotta. |
| Acqua – benzene | 33.6 | Interfaccia tra liquidi immiscibili, utile per studi di emulsioni. |
| Acqua – olio d’oliva | 20.6 | Analogo dei sistemi biologici olio-acqua (membrane cellulari). |
| Mercurio – acqua | 427.0 | Forte discontinuità interfacciale; modello per studi di adesione. |
| Ossigeno – aria (–193 °C) | 15.7 | Valore a bassa temperatura; applicazioni in criobiologia. |
| Alcol etilico – aria | 22.3 | Liquido con tensione superficiale moderata. |
| Carburi alifatici saturi – aria | 20.0 | Molecole idrofobiche con basso valore di τ. |
| Olio d’oliva – aria | 32.0 | Utilizzato come modello di lipidi biologici. |
| Urina – aria | 66.0 | Rilevante in urodinamica e patologie renali. |
| Bile – aria | 45.0 | Coinvolta nella digestione; ridotta da sali biliari (tensioattivi biologici). |
| Saliva – aria | 18.0 | Importante per la lubrificazione orale. |
| Sudore – aria | 69.0 | Valori vicini all’acqua pura, ma modulati da sali disciolti. |
| Glicerina – aria | 64.5 | Alta tensione superficiale; usata come fluido modello. |
| Paraffina – aria (60 °C) | 33.1 | Impiegata come riferimento in processi industriali. |
| Liquido alveolare polmonare – aria | ~25 | Rilevante in fisiologia respiratoria; modulato dal surfattante polmonare. |
| Plasma sanguigno – aria | ~55 | Valore intermedio; influenza fenomeni di schiuma ematica. |
Tensione superficiale a diverse interfacce (20 °C)
Valori del coefficiente di tensione superficiale misurati a 20 °C per differenti interfacce.