Legame chimico
Definizione
Un legame chimico si forma quando due o più atomi vengono uniti da forze di attrazione che li tengono insieme in una struttura stabile. Tali forze possono derivare dal trasferimento di elettroni da un atomo all’altro (legame ionico) oppure dalla condivisione di coppie di elettroni tra gli atomi (legame covalente).
Una volta che gli elementi si combinano per formare un composto, essi non possono essere separati mediante processi fisici: per ottenere nuovamente gli elementi originari è necessaria una reazione chimica. Le proprietà chimiche e fisiche di un composto dipendono dalla sua struttura, la quale è determinata dalla disposizione degli elettroni negli atomi che lo costituiscono.
Caratteristiche come la solubilità, i punti di fusione e di ebollizione sono strettamente legate alla forma delle molecole, alla distribuzione delle cariche e quindi alla polarità delle unità che compongono il composto. È pertanto fondamentale saper attribuire correttamente il nome e la formula chimica dei composti ionici e covalenti, conoscere le loro principali proprietà e comprendere il legame tra queste proprietà, la struttura molecolare e il tipo di legame.
Quando più atomi formano un composto, essi sono tenuti insieme in una disposizione spaziale definita da una forza di attrazione che supera la repulsione tra i nuclei positivi. Le interazioni tra gli elettroni di valenza sono alla base della formazione dei legami chimici: per questo motivo l’analisi del legame si concentra sul comportamento degli elettroni di valenza prima e dopo la formazione del composto.
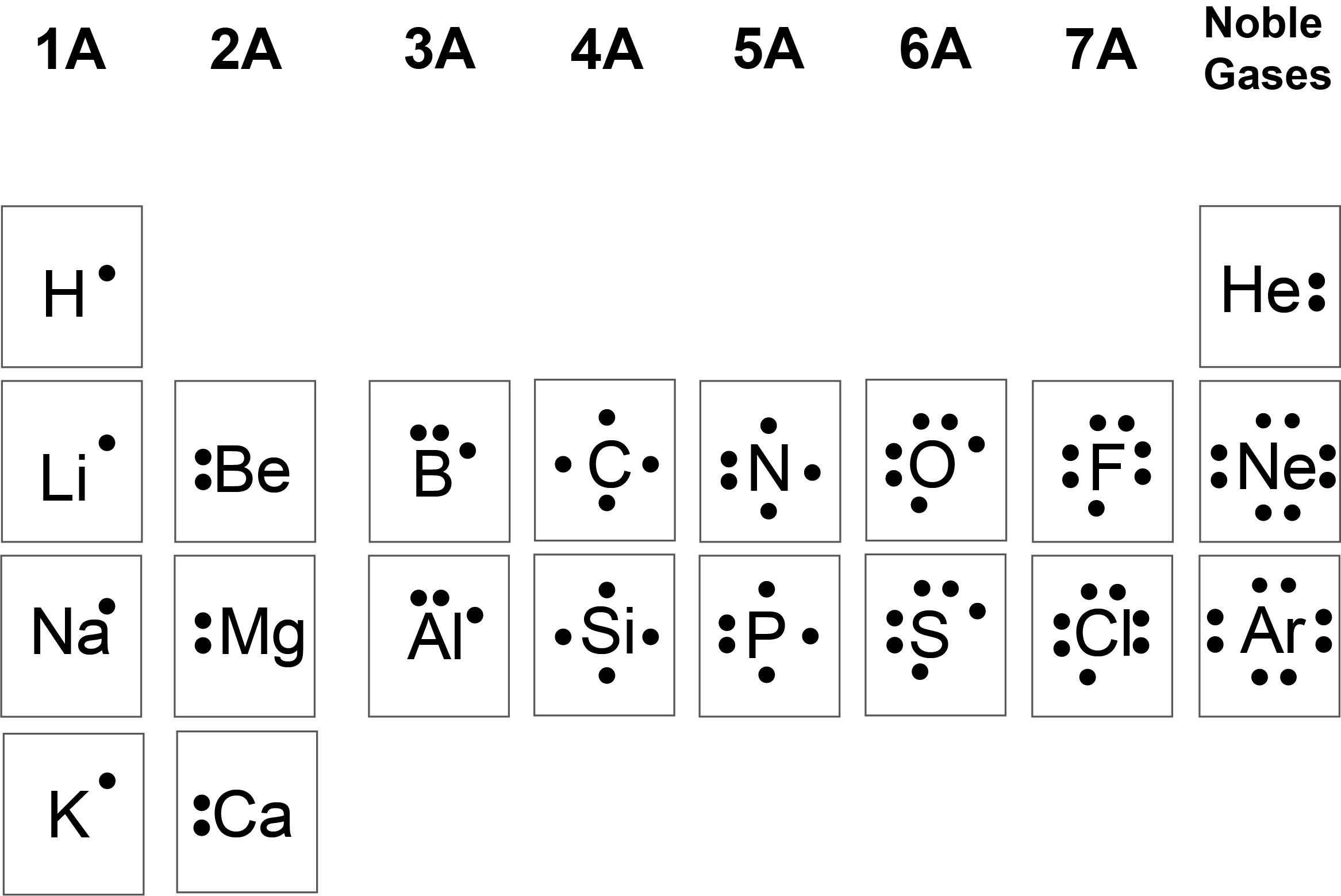
La notazione di Lewis, introdotta da Gilbert N. Lewis nei primi decenni del XX secolo, utilizza il simbolo dell’elemento per rappresentare il “nocciolo” atomico (nucleo più elettroni di core) e dispone intorno ad esso punti che indicano gli elettroni di valenza. Il punto di forza di questo formalismo è la sua focalizzazione sugli elettroni effettivamente coinvolti nella formazione dei legami chimici, in accordo con la regola dell’ottetto per gli elementi dei gruppi principali. La (Figura 01.13-01) riporta le formule di Lewis per diversi elementi rappresentativi: il numero di punti corrisponde al numero di elettroni presenti nel livello energetico più esterno.
Nella pratica, i quattro “lati” che circondano il simbolo chimico vengono interpretati come sedi per i quattro orbitali del livello di valenza nei blocchi s e p, ossia un orbitale s e tre orbitali p. Poiché un orbitale può accogliere al massimo due elettroni, su ciascun lato non si collocano più di due punti; per analogia con la regola di Hund, si tende a distribuire inizialmente elettroni spaiati su lati diversi prima di appaiarli. I punti non appaiati rappresentano siti potenzialmente disponibili alla formazione di legami covalenti mediante accoppiamento con elettroni di un altro atomo, mentre le coppie già formate indicano coppie di non legame. Si noti che la regola dell’ottetto trova applicazione soprattutto per gli elementi dei gruppi principali: idrogeno ed elio seguono il duetto, mentre per i metalli di transizione la descrizione di Lewis è meno predittiva e richiede modelli elettronici più articolati.
I legami chimici più diffusi sono riconducibili a due archetipi, ionico e covalente, entrambi governati dal comportamento degli elettroni di valenza. Nel legame ionico si osserva un trasferimento di elettroni da un atomo a un altro, mentre nel legame covalente gli elettroni vengono condivisi tra i nuclei coinvolti. È importante, tuttavia, concepire questi modelli come gli estremi di un continuum: alcuni composti mostrano carattere fortemente ionico, altri marcatamente covalente, ma molte specie reali presentano contributi di entrambe le nature.
Legame ionico
Per molti elementi rappresentativi, la stabilità chimica è efficacemente descritta dalla “regola dell’ottetto”: la tendenza a conseguire una configurazione elettronica simile a quella dei gas nobili riempiendo l’involucro di valenza. In un processo ionico, atomi con bassa energia di ionizzazione cedono elettroni formando cationi, mentre atomi con elevata affinità elettronica acquistano elettroni formando anioni; l’attrazione coulombiana tra cariche opposte costituisce l’essenza del legame ionico.
Un esempio didatticamente equivalente al caso classico del cloruro di sodio è la reazione tra litio e bromo, che porta a bromuro di litio: 2Li + Br2 → 2LiBr. Il litio, caratterizzato da energia di ionizzazione relativamente bassa, tende a perdere un elettrone diventando isoelettronico con l’elio, generando Li+. Il bromo, più elettronegativo, tende invece a ricevere un elettrone, acquisendo la configurazione dell’argo e formando Br−. La forza elettrostatica tra Li+ e Br− stabilizza il solido ionico risultante. La stessa logica si applica al sistema Na/Cl, come illustrato nelle figure sottostanti.
Ricordiamo che un atomo metallico tipico (come il sodio) presenta:
- energia di ionizzazione bassa, per cui l’allontanamento di un elettrone è relativamente agevole;
- affinità elettronica modesta, quindi scarsa propensione ad accettare elettroni.
La formazione del catione sodio, isoelettronico con il neon, può essere schematizzata come: Na → Na+ + e−. Per contro, un non metallo come il cloro mostra:
- energia di ionizzazione elevata, che rende poco favorevole la cessione di elettroni;
- affinità elettronica elevata, che favorisce l’acquisizione di un elettrone e la formazione di Cl−.
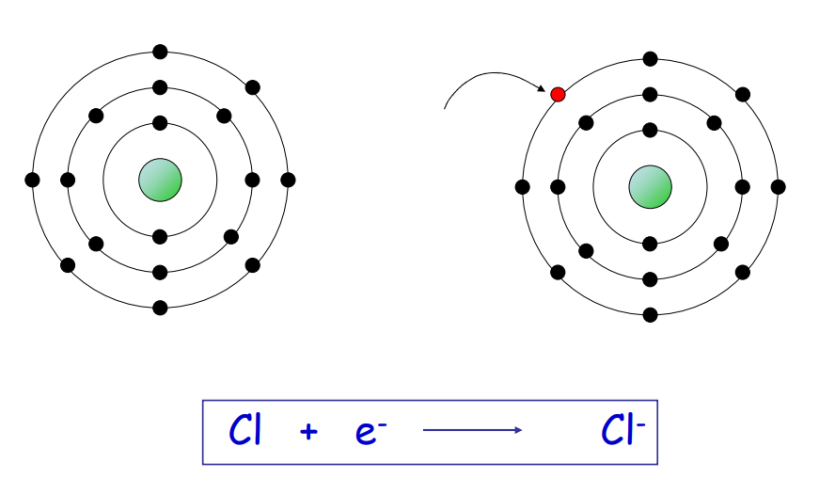 |
| Formazione dello ione cloruro Cl⁻ per acquisizione di un elettrone |
L’elettrone perso dall’atomo donatore viene acquisito dall’atomo accettore, generando una coppia di ioni di carica opposta:
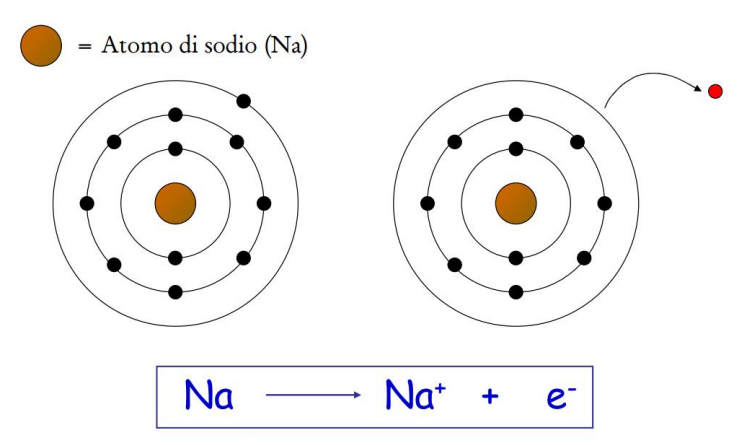 |
| Formazione dello ione sodio Na⁺ per perdita di un elettrone |
L’interazione attrattiva tra Na+ e Cl− è di natura coulombiana. In termini energetici, la stabilizzazione cresce con il prodotto delle cariche e diminuisce con la distanza interionica, secondo la legge di Coulomb: \( E \propto -\dfrac{q_1 q_2}{4\pi \varepsilon_0 r} \). Alcune proprietà chiave del legame ionico possono essere sintetizzate come segue:
- gli elementi metallici, con bassa energia di ionizzazione e scarsa affinità per l’elettrone, tendono a formare cationi;
- i non metalli, con alta energia di ionizzazione e affinità elettronica significativa, tendono a formare anioni;
- il trasferimento effettivo di uno o più elettroni genera specie cariche, responsabili della coesione elettrostatica del reticolo;
- il legame ionico consiste nell’attrazione tra ioni di carica opposta, che costituisce la forza di coesione del solido;
- reazioni tra metalli e non metalli dei blocchi s e p (rispettivamente a sinistra e a destra della tavola periodica) portano frequentemente a solidi ionici.
Nel solido cristallino non esistono “coppie ioniche” isolate: ciascun catione interagisce con più anioni e viceversa, dando origine a un reticolo cristallino tridimensionale periodico. Nel cloruro di sodio, la geometria del reticolo è mostrata in (Figura 01.13-02). L’energia reticolare, grandezza che misura la stabilità del solido ionico, è coerente con l’elevato punto di fusione e con la fragilità tipica dei cristalli ionici.
Legame covalente
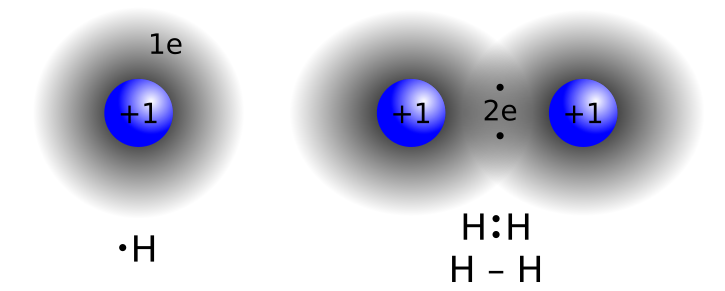
La regola dell’ottetto guida anche la formazione di legami covalenti: gli atomi condividono coppie elettroniche fino a raggiungere involucri di valenza stabili. Consideriamo la combinazione di due atomi di idrogeno. Singoli atomi di H sono instabili; la condivisione di due elettroni in una coppia di legame produce la molecola biatomica H2, stabilizzando entrambi gli atomi con un “duetto” elettronico analogo alla configurazione dell’elio.
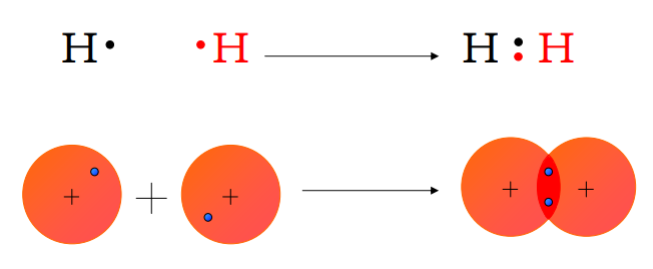 |
| Formazione del legame covalente nella molecola di idrogeno H₂ |
Poiché due atomi identici di H hanno la stessa tendenza ad attrarre o cedere elettroni, il trasferimento completo è improbabile in condizioni ordinarie; la condivisione di una coppia elettronica è quindi il meccanismo di stabilizzazione pertinente, come rappresentato con le strutture di Lewis.
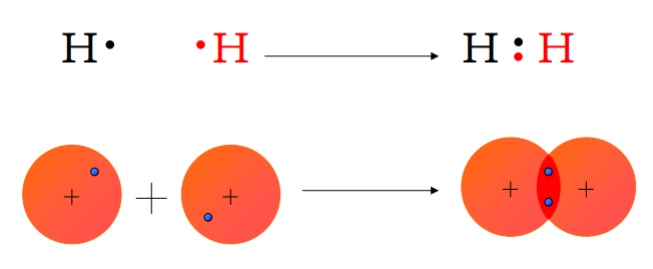 |
| Legame covalente tra due atomi di idrogeno – formazione di H₂ |
Quando gli elettroni sono condivisi e localizzati prevalentemente tra due nuclei, si forma un legame covalente singolo (Figura 01.13-03). Le specie tenute insieme da legami covalenti sono molecole, cioè insiemi elettricamente neutri di due o più atomi. Le strutture di Lewis rappresentano gli elettroni di valenza come coppie di legame o coppie non condivise (coppie solitarie). I legami covalenti insorgono tipicamente tra atomi con analoga propensione ad acquistare o perdere elettroni. Esempi paradigmatici di legami “omopolari” sono nelle biatomiche H2, O2, N2, F2, Cl2, Br2, I2, per le quali il trasferimento integrale di carica è privo di significato fra atomi identici.
 |
| Molecola di fluoro – struttura di Lewis di F₂ |
Come per H2, anche in F2 la coppia elettronica di legame è localizzata tra i due atomi, mentre le coppie solitarie restano su ciascun atomo esterno. Legami covalenti si instaurano pure tra atomi diversi, generando talvolta una distribuzione asimmetrica della densità elettronica. Di seguito sono riportati esempi di molecole binarie e poliatomiche comuni con legami covalenti:

|
| Molecola di fluoruro di idrogeno – struttura di Lewis di HF |
 |
| Molecola di metano – struttura di Lewis di CH₄ |
 |
| Molecola di ammoniaca – struttura di Lewis di NH₃ |
 |
| Molecola d’acqua – struttura di Lewis di H₂O |
In queste strutture, l’assetto elettronico di ciascun atomo non idrogeno rispetta l’ottetto; l’idrogeno raggiunge il duetto. Il conteggio degli elettroni di valenza risulta:
- in HF il fluoro presenta due elettroni condivisi nel legame F–H e tre coppie solitarie;
- in H2O l’ossigeno mostra due legami O–H (quattro elettroni condivisi) e due coppie solitarie;
- in CH4 il carbonio è circondato da quattro legami C–H, per un totale di otto elettroni condivisi;
- in NH3 l’azoto forma tre legami N–H (sei elettroni condivisi) e possiede una coppia solitaria.
Analoghi bilanci elettronici si riscontrano in CO2 (due doppi legami C=O con nessuna coppia solitaria sul carbonio) e in H2S (due legami S–H e due coppie solitarie sullo zolfo), a sottolineare la generalità della regola dell’ottetto per i composti del secondo periodo, pur con note eccezioni in altri casi (Figura 01.13-04).
Legame covalente polare
La condivisione elettronica in un legame covalente non implica necessariamente ripartizione uniforme della densità di carica. Nelle biatomiche omonucleari, come H2 o N2, gli elettroni trascorrono mediamente lo stesso tempo in prossimità di ciascun nucleo. Se invece i due atomi sono diversi, la condivisione può risultare asimmetrica. Nel fluoruro di idrogeno, per esempio, la densità elettronica del legame è spostata verso il fluoro: si parla di legame covalente polare:
- parziale trasferimento di carica: il legame mostra un ibrido di carattere ionico e covalente;
- distribuzione di densità disuguale: l’area attorno all’atomo più elettronegativo risulta più ricca di elettroni;
- dipolo di legame: la regione elettron-rich è parzialmente negativa (δ−), quella elettron-poor è parzialmente positiva (δ+), generando un dipolo; il momento dipolare può essere descritto, in prima approssimazione, come \( \mu = \delta \, r \), dove r è la distanza interatomica.
L’andamento periodico aiuta a prevedere la polarità dei legami. Gli elementi che tendono ad acquistare elettroni si dispongono a destra della tavola periodica, mentre quelli che li cedono si collocano a sinistra. L’intensità con cui un atomo “attira” gli elettroni di legame è riassunta dal concetto di elettronegatività.
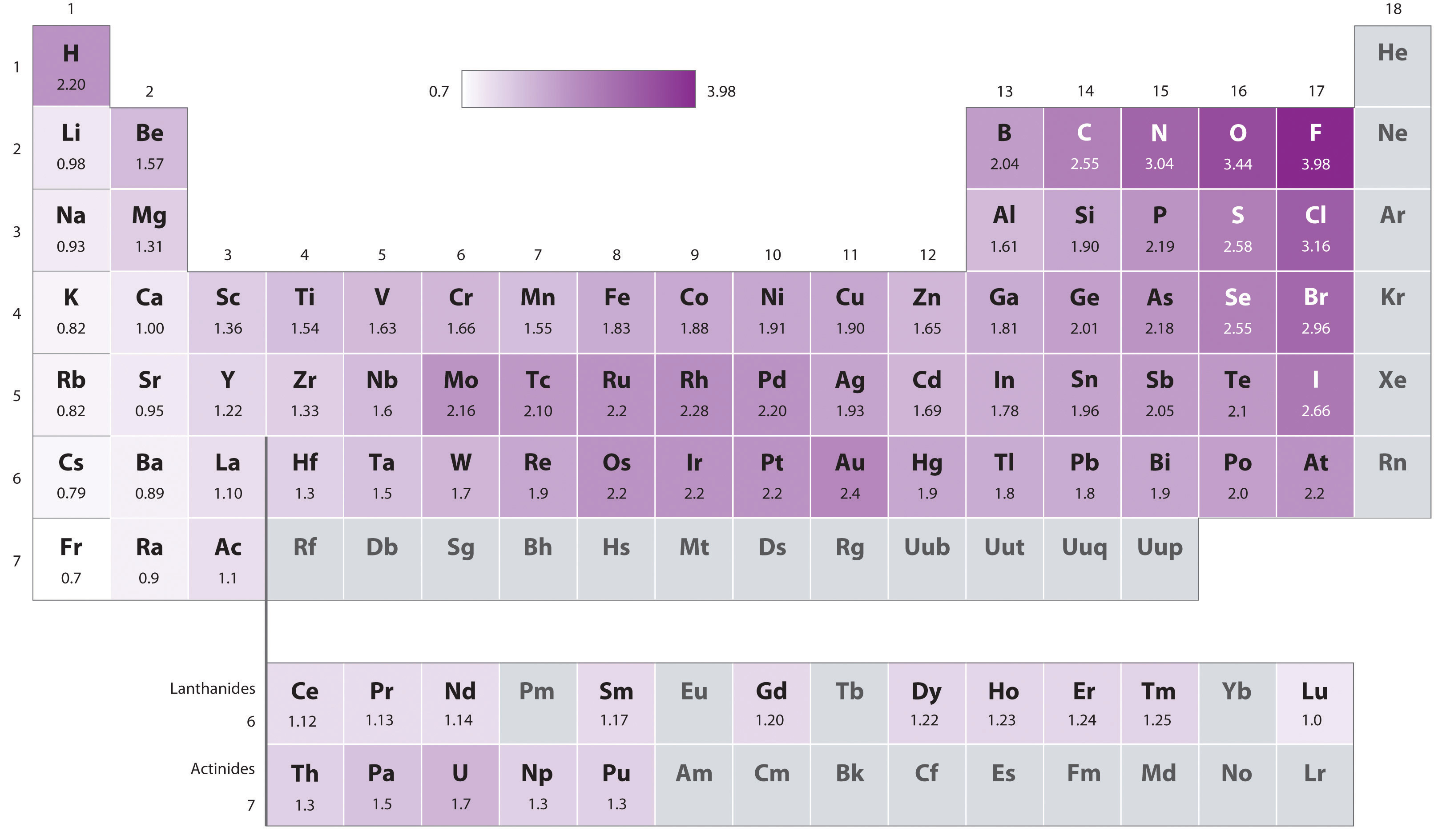
Elettronegatività
L’elettronegatività, En, misura la capacità relativa di un atomo di attrarre verso di sé gli elettroni condivisi in un legame. I valori tabulati più usati derivano dalla scala di Pauling e si estendono approssimativamente da 0,7 per gli elementi meno elettronegativi a 4,0 per il fluoro, l’elemento più elettronegativo. La distribuzione dei valori in funzione della posizione nella tavola periodica (Figura 01.13-05) mostra un incremento generale procedendo da sinistra a destra lungo un periodo e dal basso verso l’alto in un gruppo, con alcune eccezioni dovute a effetti di configurazione elettronica e schermaggio.
La differenza di elettronegatività, \( \Delta \chi \), fra due atomi è un indicatore del grado di polarità del legame:
- i valori possono essere tratti dalla scala di Pauling (altre scale diffuse includono Mulliken e Allred–Rochow);
- per l’idrogeno, \( \chi_\mathrm{H} \approx 2{,}20 \) sulla scala di Pauling;
- per una molecola omonucleare come Cl2, la differenza risulta.
\[ \Delta \chi = \chi_\mathrm{Cl} - \chi_\mathrm{Cl} = 3{,}16 - 3{,}16 = 0 \]
Un valore di \( \Delta \chi = 0 \) corrisponde a un legame covalente non polare. In generale, legami fra atomi identici sono omopolari. Quando \( \Delta \chi \) è piccola ma non nulla (ad esempio inferiore a circa 0,5), la polarità è debole e si tende a classificare il legame come sostanzialmente non polare; al crescere di \( \Delta \chi \) aumenta la polarità del legame. Valori molto elevati (intorno a 1,9 o superiori, a seconda del contesto) sono spesso associati a legami con marcato contributo ionico, anche se la distinzione netta resta convenzionale e dipendente dal sistema considerato. L’interpretazione congiunta di elettronegatività, struttura del reticolo o geometria molecolare e proprietà macroscopiche (punti di fusione, solubilità, conducibilità) consente una classificazione coerente del tipo di legame.