Fecondazione e meiosi si alternano nei cicli vitali sessuati
Definizione
L’anima idrofoba del doppio strato fosfolipidico costituisce una barriera energetica che ostacola il passaggio delle specie idrofile, inclusi tutti gli ioni. Le molecole polari in acqua mostrano un’elevata affinità per l’idratazione e, di conseguenza, evitano l’ambiente apolare del core lipidico, così come le molecole idrofobe evitano il solvente acquoso. Ciononostante, cellule e organelli devono scambiare con l’ambiente un’ampia gamma di soluti idrofili, tra cui ioni inorganici, zuccheri, amminoacidi, nucleotidi e svariati intermedi metabolici.
Per gran parte di queste specie, l’attraversamento per diffusione semplice è troppo lento per sostenere le esigenze fisiologiche; il flusso viene quindi accelerato da proteine di membrana specializzate, dando luogo al trasporto facilitato. In termini generali, due grandi classi di proteine mediano tale movimento: i canali, che forniscono percorsi idrofili attraverso la membrana, e i trasportatori (o carrier), che si legano selettivamente i soluti e ne catalizzano il trasferimento attraverso la barriera lipidica. A queste si affiancano pompe dipendenti da energia metabolica, che spostano attivamente soluti contro i relativi gradienti. I principi fisico-chimici che regolano la permeabilità e le differenze di concentrazione, soprattutto per gli ioni inorganici, sono alla base di processi cellulari essenziali.
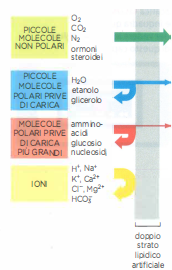
Sebbene, su tempi molto lunghi, qualsiasi molecola possa attraversare il doppio strato, la velocità di diffusione dipende in modo critico da dimensione, polarità e idrofobicità. In generale, specie più piccole e non polari diffondono più rapidamente; al contrario, molecole polari e idratate incontrano una barriera energetica elevata. La facilità relativa con cui differenti soluti attraversano un doppio strato privo di proteine è sintetizzata in (Figura 05.04-01):
- Piccole molecole apolari, come l’ossigeno (O₂, 32 Da) e l’anidride carbonica (CO₂, 44 Da), si dissolvono agevolmente nella fase idrocarburica e la attraversano in tempi brevi per diffusione; questa permeabilità ai gas è cruciale per gli scambi respiratori;
- Soluti polari privi di carica possono diffondere se sufficientemente piccoli: l’acqua (H₂O, 18 Da) e l’etanolo (46 Da) attraversano relativamente in fretta, mentre molecole più voluminose come il glicerolo (92 Da) lo fanno con maggiore lentezza; per dimensioni maggiori, ad esempio il glucosio (180 Da), la permeazione è trascurabile in assenza di proteine;
- Il doppio strato è fortemente impermeabile alle specie cariche, inclusi piccoli ioni inorganici: l’elevata energia di disidratazione necessaria per strappare l’idratazione e migrare nella fase apolare costituisce una barriera sostanziale; un doppio strato privo di proteine risulta circa \(10^9\) volte più permeabile all’acqua che agli ioni monovalenti come Na⁺ o K⁺.
Poiché le membrane biologiche limitano la diffusione degli ioni, le cellule mantengono composizioni elettrolitiche interne molto diverse da quelle del fluido circostante. Tali asimmetrie sono indispensabili per funzioni chiave, tra cui la produzione di ATP, la regolazione del volume cellulare e la trasmissione dei segnali elettrici. Tra gli ioni principali figurano Na⁺, K⁺, Ca²⁺, Cl⁻ e H⁺, i cui gradienti transmembrana sono stabiliti e preservati da trasportatori e pompe specifiche (Tabella 05.04-01).
Nelle cellule animali, il Na⁺ è tipicamente più concentrato all’esterno, mentre il K⁺ predomina nel citosol (Tabella 05.04-01). Il mantenimento dell’elettroneutralità richiede che, in ogni compartimento, le cariche positive siano bilanciate da cariche negative. Così, l’elevato Na⁺ extracellulare è controbilanciato principalmente dal Cl⁻, mentre l’abbondanza intracellulare di K⁺ è accompagnata da anioni organici e inorganici, inclusi proteine, acidi nucleici e metaboliti fosforilati. La pompa Na⁺/K⁺-ATPasi, unitamente ad altri sistemi di trasporto, contribuisce in modo determinante a queste distribuzioni ioniche.
| Ione | Concentrazione intracellulare (mM) | Concentrazione extracellulare (mM) |
|---|---|---|
| Na⁺ | 5–15 | 145 |
| K⁺ | ~140 | 5 |
| Mg²⁺ | ~0,5 (ioni liberi) | 1–2 |
| Ca²⁺ | 10⁻⁴ | 1–2 |
| H⁺ | 7 × 10⁻⁵ (pH ~7,2) | 4 × 10⁻⁵ (pH ~7,4) |
| Cl⁻ | 5–15 | 110 |
Distribuzione ionica nelle cellule dei mammiferi
Le cellule dei mammiferi mantengono un preciso gradiente ionico tra interno ed esterno, fondamentale per l’omeostasi e la trasmissione dei segnali. Alte concentrazioni di sodio e cloro caratterizzano l’ambiente extracellulare, mentre il potassio predomina nel citoplasma. Il calcio libero intracellulare rimane a livelli estremamente bassi, garantendo la corretta regolazione di processi come contrazione muscolare e segnalazione intracellulare.
| Ione | Concentrazione intracellulare (mM) | Concentrazione extracellulare (mM) |
|---|---|---|
| Na⁺ | 5–15 | 145 |
| K⁺ | ~140 | 5 |
| Mg²⁺ | ~0,5 (ioni liberi) | 1–2 |
| Ca²⁺ | 10⁻⁴ | 1–2 |
| H⁺ | 7 × 10⁻⁵ (pH ~7,2) | 4 × 10⁻⁵ (pH ~7,4) |
| Cl⁻ | 5–15 | 110 |
Distribuzione ionica nelle cellule dei mammiferi
Le cellule dei mammiferi mantengono un preciso gradiente ionico tra interno ed esterno, fondamentale per l’omeostasi e la trasmissione dei segnali. Alte concentrazioni di sodio e cloro caratterizzano l’ambiente extracellulare, mentre il potassio predomina nel citoplasma. Il calcio libero intracellulare rimane a livelli estremamente bassi, garantendo la corretta regolazione di processi come contrazione muscolare e segnalazione intracellulare.
Benché l’elettroneutralità globale sia rispettata dentro e fuori la cellula, nelle immediate vicinanze della membrana si accumulano piccole quantità di carica opposta sui due lati. Questa separazione spaziale di carica origina una differenza di potenziale, il potenziale di membrana. In condizioni stazionarie, gli ingressi e le uscite di cationi e anioni risultano bilanciati e il potenziale di membrana a riposo è costante ma, per convenzione, negativo all’interno rispetto all’esterno. Nelle cellule animali i valori tipici si collocano tra −20 e −200 mV, in funzione dell’organismo e del tipo cellulare.
Il potenziale di membrana immagazzina energia utile per il trasporto accoppiato di nutrienti e per i processi di segnalazione elettrica nelle cellule eccitabili. Il valore a riposo riflette la permeabilità selettiva della membrana a specifici ioni e i loro gradienti di concentrazione. Per un singolo ione permeante, il potenziale di equilibrio è descritto dall’equazione di Nernst:
\[ E_{X} = \frac{RT}{zF}\,\ln\!\left(\frac{[X]_{\text{est}}}{[X]_{\text{int}}}\right), \]
dove \(R\) è la costante dei gas, \(T\) la temperatura assoluta, \(F\) la costante di Faraday, \(z\) la valenza dello ione e \([X]_{\text{est}}\), \([X]_{\text{int}}\) le concentrazioni esterna e interna. In condizioni fisiologiche, l’azione combinata di canali selettivi e trasportatori elettrogenici consente di instaurare e mantenere questi potenziali, come verrà modulato dinamicamente durante l’attività cellulare.
Le proteine deputate al trasferimento selettivo di soluti idrofili sono componenti onnipresenti delle membrane biologiche e presentano una notevole varietà strutturale. Ciascun tipo di proteina consente il passaggio preferenziale di una determinata classe di piccole molecole in soluzione acquosa, come ioni, zuccheri o amminoacidi, garantendo percorsi dedicati attraverso la barriera lipidica. Tale specializzazione fa sì che ogni membrana – plasmatica o di organulo – possieda un corredo caratteristico di trasportatori, il quale determina il profilo dei soluti che possono entrare o uscire.
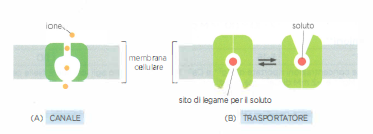
Molti di questi componenti sono proteine transmembrana multipasso: la catena polipeptidica attraversa ripetutamente il doppio strato lipidico e, ripiegandosi, delimita un corridoio idrofilo continuo che consente a molecole polari di piccolo diametro di evitare il contatto diretto con il core idrofobo della membrana. Due sono le classi funzionali principali (Figura 05.04-02):
- i canali formano pori acquosi che selezionano i permeanti soprattutto in base al raggio idrato e alla carica, grazie a filtri di selettività e campi elettrici locali; quando il poro è nello stato aperto, i soluti idonei diffondono rapidamente secondo il loro gradiente elettrochimico;
- i trasportatori (o carrier) operano per “accesso alternante”, legando lo specifico soluto a siti di alta affinità e sottoponendosi a cambi conformazionali che espongono il sito di legame a un lato della membrana per volta; l’elevata specificità del legame, paragonabile a quella enzimatica, è alla base della selettività del processo.
Molti canali sono inoltre regolati (gated) da voltaggio, ligandi o tensione di membrana, mentre i trasportatori possono funzionare come uniporto, simporto o antiporto, a seconda del numero e della direzione dei soluti coinvolti.
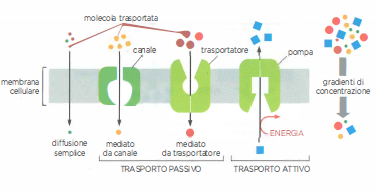
Il verso del flusso transmembrana dipende spesso dal confronto tra le concentrazioni del soluto sui due lati. In presenza di un percorso conduttivo, le molecole migrano spontaneamente “a valle” da regioni a concentrazione maggiore verso regioni a concentrazione minore: si tratta di trasporto passivo, che non richiede apporto energetico alla proteina. Pur essendo bidirezionale a livello microscopico, il flusso netto si annulla all’equilibrio. Tutti i canali e numerosi trasportatori (uniporti) mediano questo tipo di diffusione facilitata.
Per trasferire un soluto “a monte”, ossia contro il gradiente di concentrazione, la proteina di trasporto deve compiere lavoro accoppiando il trasferimento a una fonte di energia: si parla allora di trasporto attivo, operato da pompe specializzate (Figura 05.04-03). Le principali modalità di alimentazione sono:
- idrolisi dell’ATP da parte di ATPasi di membrana (trasporto attivo primario);
- sfruttamento di un gradiente ionico preesistente, creato da altre pompe, per trascinare un secondo soluto contro gradiente (trasporto attivo secondario tramite simporti o antiporti);
- energia luminosa, utilizzata da pompe fotoattivate in specifici organismi o organelli.
In ogni caso, la direzione e la capacità di accumulo dipendono dal bilancio energetico del sistema, che vincola l’ampiezza del gradiente ottenibile.
Per soluti elettricamente neutri, il flusso passivo è governato esclusivamente dal gradiente di concentrazione. Per ioni e piccole molecole cariche, interviene anche il potenziale elettrico transmembrana, generalmente negativo dal lato citoplasmatico rispetto a quello extracellulare. Il potenziale negativo intracellulare attrae cationi e respinge anioni.
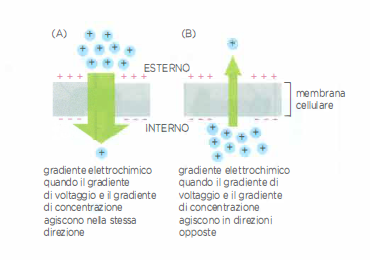
La “forza motrice” complessiva che governa il movimento di una specie carica è il suo gradiente elettrochimico, somma di contributi chimici ed elettrici. In forma energetica, per un soluto di valenza \( z \) vale:
\(\displaystyle \Delta \mu = RT \ln\!\left(\frac{C_{\text{in}}}{C_{\text{out}}}\right) + zF\,\Delta V\)
dove \( R \) è la costante dei gas, \( T \) la temperatura assoluta, \( F \) la costante di Faraday e \( \Delta V = V_{\text{in}} - V_{\text{out}} \) il potenziale di membrana. Quando gradiente di concentrazione e differenza di potenziale spingono nella stessa direzione, il gradiente elettrochimico è ripido (Figura 05.04-04): è tipico dello ione Na⁺, la cui concentrazione extracellulare è maggiore di quella intracellulare (Tabella 05.04-01) e che, se esiste un canale aperto, entra con decisione nella cellula. Se invece i due contributi si oppongono, il gradiente risultante può essere modesto (Figura 05.04-04), come avviene per K⁺, abbondante nel citosol ma soggetto all’attrazione del potenziale negativo interno. In condizioni di riposo, anche con canali per K⁺ aperti, il flusso netto può rimanere contenuto.
La concentrazione alla quale il gradiente chimico bilancia esattamente l’effetto del voltaggio definisce il potenziale di equilibrio dello ione, dato dall’equazione di Nernst: \(\displaystyle E_z = \frac{RT}{zF}\ln\!\left(\frac{[\text{out}]}{[\text{in}]}\right)\). A 37 °C, per K⁺ con concentrazioni tipiche \([\text{K}^+]_{\text{in}} \approx 140\,\text{mM}\) e \([\text{K}^+]_{\text{out}} \approx 4\,\text{mM}\), si ottiene \(E_{K} \approx -90\,\text{mV}\), valore vicino al potenziale di membrana a riposo di molte cellule eccitabili.
| Ione | Concentrazione intracellulare (mM) | Concentrazione extracellulare (mM) |
|---|---|---|
| Na⁺ | 5–15 | 145 |
| K⁺ | ~140 | 5 |
| Mg²⁺ | ~0,5 (ioni liberi) | 1–2 |
| Ca²⁺ | 10⁻⁴ | 1–2 |
| H⁺ | 7 × 10⁻⁵ (pH ~7,2) | 4 × 10⁻⁵ (pH ~7,4) |
| Cl⁻ | 5–15 | 110 |
Distribuzione ionica nelle cellule dei mammiferi
Le cellule dei mammiferi mantengono un preciso gradiente ionico tra interno ed esterno, fondamentale per l’omeostasi e la trasmissione dei segnali. Alte concentrazioni di sodio e cloro caratterizzano l’ambiente extracellulare, mentre il potassio predomina nel citoplasma. Il calcio libero intracellulare rimane a livelli estremamente bassi, garantendo la corretta regolazione di processi come contrazione muscolare e segnalazione intracellulare.
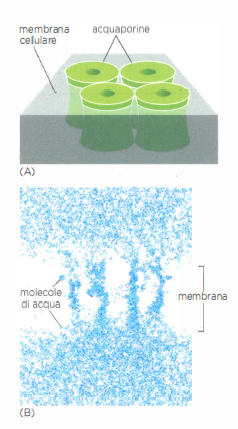
L’acqua costituisce circa il 70% della massa cellulare e il suo traffico transmembrana è cruciale per l’omeostasi. Nonostante la scarsa permeabilità del doppio strato ai soluti polari, le molecole d’acqua possono attraversarlo lentamente per diffusione (Figura 05.04-01). In numerosi tipi cellulari, canali specializzati, le acquaporine, aumentano di ordini di grandezza la conducibilità all’acqua, pur escludendo protoni e altre specie cariche grazie a filtri stretti e a orientamenti dipolari specifici (Figura 05.04-05). Nel rene dei vertebrati, ad esempio, l’espressione e il reclutamento delle acquaporine alla membrana apicale e basolaterale modulano finemente il riassorbimento idrico.
La direzione del flusso idrico dipende dal gradiente di attività dell’acqua, che in soluzione è inversamente correlata alla concentrazione totale dei soluti. L’osmolarità cellulare è spesso maggiore di quella dell’ambiente esterno (Tabella 05.04-01); di conseguenza, l’acqua tende a entrare nella cellula. Il movimento dell’acqua da regioni a bassa concentrazione di soluti verso regioni ad alta concentrazione di soluti è definito osmosi. La pressione osmotica idealmente associata a una soluzione diluita è data dalla relazione di van ’t Hoff: \(\displaystyle \Pi = R T\, C_{\text{tot}}\), dove \(C_{\text{tot}}\) è la somma delle concentrazioni delle specie osmoticamente attive.
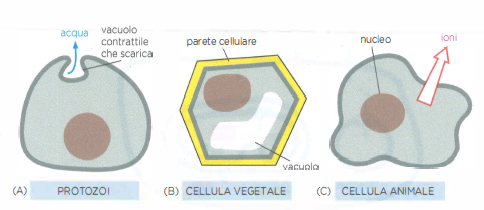
Senza adeguati meccanismi di compenso, l’osmosi determinerebbe rigonfiamento cellulare e potenziale lisi. Gli organismi hanno evoluto diverse strategie (Figura 05.04-06):
- protozoi d’acqua dolce espellono periodicamente l’eccesso di acqua mediante vacuoli contrattili che si svuotano all’esterno (Figura 05.04-06);
- nelle cellule vegetali, la parete cellulare rigida controbilancia la pressione di turgore generata dall’ingresso di acqua, conferendo sostegno meccanico a fusti e foglie; la perdita di turgore causa l’appassimento (Figura 05.04-06);
- le cellule animali mantengono l’equilibrio osmotico regolando il contenuto di soluti, in particolare tramite pompe ioniche come la Na⁺/K⁺-ATPasi, che contribuisce a tenere basso il sodio intracellulare e a minimizzare l’ingresso osmotico di acqua (Figura 05.04-06).
Un esempio numerico: se una cellula animale raddoppiasse improvvisamente la propria concentrazione intracellulare di Na⁺ da 10,0 a 20,0 mM senza attivare la Na⁺/K⁺-ATPasi, l’aumento di osmolarità citosolica determinerebbe un ingresso d’acqua che ne incrementerebbe il volume finché la tensione di membrana o la rimozione di soluti non riportassero il sistema verso l’equilibrio.
| Ione | Concentrazione intracellulare (mM) | Concentrazione extracellulare (mM) |
|---|---|---|
| Na⁺ | 5–15 | 145 |
| K⁺ | ~140 | 5 |
| Mg²⁺ | ~0,5 (ioni liberi) | 1–2 |
| Ca²⁺ | 10⁻⁴ | 1–2 |
| H⁺ | 7 × 10⁻⁵ (pH ~7,2) | 4 × 10⁻⁵ (pH ~7,4) |
| Cl⁻ | 5–15 | 110 |
Distribuzione ionica nelle cellule dei mammiferi
Le cellule dei mammiferi mantengono un preciso gradiente ionico tra interno ed esterno, fondamentale per l’omeostasi e la trasmissione dei segnali. Alte concentrazioni di sodio e cloro caratterizzano l’ambiente extracellulare, mentre il potassio predomina nel citoplasma. Il calcio libero intracellulare rimane a livelli estremamente bassi, garantendo la corretta regolazione di processi come contrazione muscolare e segnalazione intracellulare.