I geni concatenati tendono a essere ereditati insieme in virtù della loro vicinanza sullo stesso cromosoma
Definizione
Per lungo tempo è rimasto oscuro il motivo per cui i sistemi di trasporto elettronico fossero incastonati in membrane biologiche. Una svolta concettuale si è verificata all’inizio degli anni ’60 del Novecento, quando fu riconosciuto che la conversione energetica richiede la formazione di un gradiente elettrochimico di protoni attraverso la membrana. L’ipotesi chemiosmotica, inizialmente accolta con scetticismo per la sua originalità, maturò grazie a verifiche sperimentali condotte con sistemi artificiali di generazione del gradiente protonico e con vescicole lipidiche ricostituite, che dimostrarono la sufficienza del gradiente per guidare la sintesi di ATP.
Pur restando attivi gli studi sui dettagli atomistici dell’accoppiamento chemiosmotico, i principi cardine sono consolidati. In queste pagine si delineano i fondamenti del trasferimento elettronico e si descrive, a livello molecolare, come il flusso di elettroni attraverso trasportatori di membrana dia origine a un gradiente di H⁺. Poiché mitocondri, cloroplasti e procarioti condividono lo stesso schema generale, tali principi hanno valore pressoché universale nel mondo biologico.
I protoni si comportano in modo peculiare rispetto ad altri cationi monovalenti quali Na⁺ e K⁺. L’idrogeno è l’elemento più abbondante nelle biomolecole e nell’acqua, e la rete di legami a idrogeno che interconnette le molecole d’acqua rende gli H⁺ straordinariamente mobili, grazie a meccanismi di “salto” protonico nella matrice acquosa. L’acqua intracellulare agisce quindi da esteso serbatoio in grado di donare o accettare protoni in tempi estremamente rapidi.
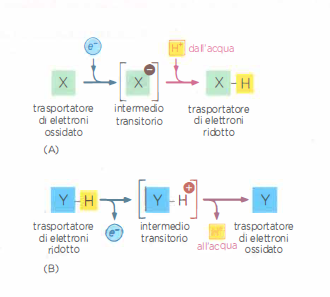
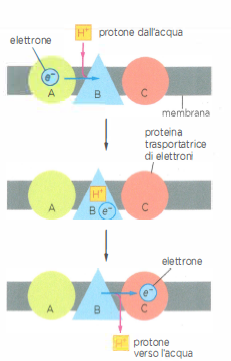
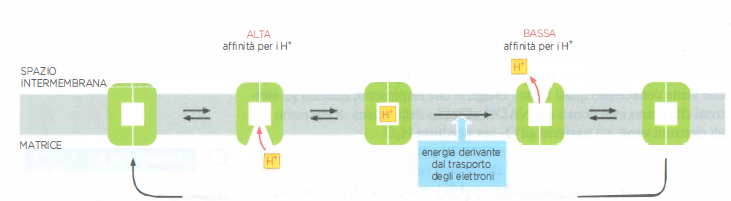
Nei processi di ossidazione e riduzione, i trasferimenti di elettroni sono frequentemente accoppiati a movimenti di protoni. Quando una specie chimica si riduce acquisendo un elettrone (e⁻), la carica negativa in eccesso viene spesso bilanciata dall’associazione di un protone dall’acqua: l’effetto netto equivale al trasferimento di un atomo di idrogeno, H⁺ + e⁻ (Figura 05.13-01). Viceversa, durante l’ossidazione, un elettrone può essere rimosso da un atomo di idrogeno della molecola, con rilascio del protone nell’acqua circostante (Figura 05.13-01). In un contesto di membrana scarsamente permeabile agli ioni, l’organizzazione spaziale dei trasportatori elettronici consente di “separare” i percorsi degli elettroni da quelli dei protoni, trasformando il trasferimento redox in un pompaggio vettoriale di H⁺ da un lato all’altro della membrana (Figura 05.13-02).
Dal punto di vista molecolare, i complessi di trasporto possono realizzare il pompaggio di protoni mediante due strategie non mutuamente esclusive:
- cicli redox con prelievo di H⁺ + e⁻ da un lato della membrana e rilascio del solo H⁺ dall’altro, mentre l’e⁻ prosegue lungo la catena di trasporto;
- cambi conformazionali accoppiati all’energia del trasferimento elettronico, che modulano l’accesso a siti protonabili alternativamente esposti ai due lati della membrana.
La membrana, elettricamente isolante per gli ioni ma conduttrice per gli elettroni all’interno dei cofattori delle proteine respiratorie, permette così di generare e mantenere un gradiente elettrochimico di H⁺, noto come forza proton-motrice. La sua espressione termodinamica è:
\[ \Delta p = \Delta \psi - \frac{2,303\,RT}{F}\,\Delta \mathrm{pH} \]
dove \(\Delta \psi\) è il potenziale di membrana, \(R\) la costante dei gas, \(T\) la temperatura assoluta, \(F\) la costante di Faraday e \(\Delta \mathrm{pH}\) la differenza di pH ai due lati della membrana. Il costo energetico per traslocare un protone contro \(\Delta p\) è:
\[ \Delta G_{\mathrm{H}^+} = F\,\Delta \psi + 2,303\,RT\,\Delta \mathrm{pH}. \]
Esempio numerico didattico: se \(\Delta \psi = 0,150\) V e \(\Delta \mathrm{pH} = 0,5\) a 298 K, allora \(\Delta G_{\mathrm{H}^+} \approx 14,5\) kJ·mol⁻¹; tre protoni richiederebbero circa 43,5 kJ·mol⁻¹, valore confrontabile con l’energia libera necessaria per sintetizzare una molecola di ATP nelle condizioni cellulari.
Le proteine della catena respiratoria orchestrano trasferimenti ordinati di elettroni tra complessi enzimatici in sequenza definita. Ogni passaggio è una reazione redox accoppiata: la specie che perde elettroni si ossida, quella che li acquista si riduce. Poiché gli elettroni non possono accumularsi liberamente, ogni ossidazione è simultanea a una riduzione corrispondente.
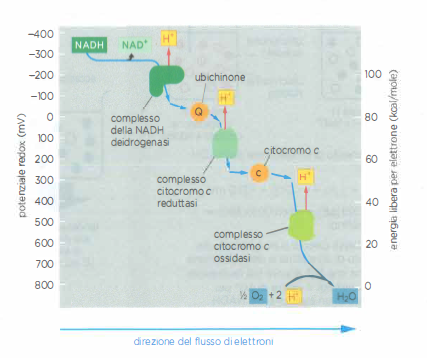
La spontaneità di un trasferimento elettronico è determinata dalla variazione di energia libera, \(\Delta G\), che riflette l’affinità relativa delle due coppie redox coinvolte. Un elettrone tende a fluire spontaneamente da una coppia con bassa affinità per gli elettroni a una coppia con affinità più elevata. Per esempio, il NADH, che porta elettroni ad alto contenuto energetico, cede prontamente tali elettroni al primo complesso della catena, la NADH deidrogenasi, in accordo con la differenza di potenziale redox tra le coppie interessate (Figura 05.13-08). Un principio analogo governa il funzionamento delle pile galvaniche, dove sostanze con differenti affinità elettroniche sono messe in contatto elettrico ma separate nello spazio.
La terminologia acidobase aiuta a fissare i concetti: gli acidi donano protoni e le basi li accettano. In modo parallelo, nelle coppie redox la forma ridotta dona elettroni e la forma ossidata li accetta. Ad esempio, per l’acido acetico vale:
CH₃COOH ⇌ CH₃COO⁻ + H⁺
mentre per la coppia nicotinammidica:
NADH ⇌ NAD⁺ + H⁺ + 2 e⁻
Qui il NADH è un donatore di elettroni; il partner NAD⁺, corrispondente forma ossidata, è un accettore relativamente debole di elettroni ad alta energia.
La tendenza di una coppia redox a cedere o ad acquisire elettroni è espressa dal suo potenziale redox standard, \(E^\circ\) (o, in biochimica, \(E^{\circ\prime}\) a pH 7). Valori più bassi di \(E^\circ\) indicano minore affinità per gli elettroni e spiccata propensione a donarli; valori più alti indicano maggiore affinità e attitudine a riceverli. In catene di trasporto biologiche, elettroni provenienti da coppie a basso potenziale (per esempio NADH/NAD⁺) scorrono verso coppie ad alto potenziale (come O₂/H₂O), fornendo l’energia necessaria per il pompaggio protonico.
La relazione tra energia libera e potenziale redox è diretta:
\[ \Delta G^\circ = -n\,F\,\Delta E^\circ, \]
dove \(n\) è il numero di elettroni trasferiti e \(\Delta E^\circ\) la differenza di potenziale tra accettore e donatore. In condizioni non standard, il potenziale di una coppia dipende anche dalle concentrazioni secondo l’equazione di Nernst:
\[ E = E^{\circ\prime} + \frac{RT}{nF}\,\ln\!\left(\frac{[\text{ossidata}]}{[\text{ridotta}]}\right). \]
Esempio numerico didattico: se una coppia accettrice ha \(E^{\circ\prime} = +0,80\) V e una coppia donatrice ha \(E^{\circ\prime} = -0,32\) V, allora \(\Delta E^{\circ\prime} = +1,12\) V per un trasferimento a 2 elettroni; di conseguenza \(\Delta G^{\circ\prime} \approx -2 \times 96\,485 \times 1,12 \approx -216\) kJ·mol⁻¹, energia sufficiente ad alimentare molteplici eventi di traslocazione protonica e la sintesi di ATP.
Nel contesto di membrana, la progressione del potenziale redox lungo la catena respiratoria è finemente graduata per assicurare che gli elettroni si muovano in modo direzionale senza “salti” e che l’energia rilasciata ad ogni stadio sia catturata in forma di gradiente protonico piuttosto che dissipata come calore. Cofattori come flavine, centri ferro-zolfo, eme dei citocromi e chinoni forniscono una gamma continua di \(E^{\circ\prime}\), permettendo un controllo preciso del flusso elettronico.
In sintesi:
- coppie redox a potenziale più basso agiscono da sorgenti di elettroni;
- coppie a potenziale più alto fungono da pozzi elettronici, come O₂/H₂O alla fine della catena;
- la differenza di potenziale, tramite \(\Delta G = -nF\Delta E\), è la “valuta” che alimenta il pompaggio di H⁺ e costruisce la forza proton-motrice, alla base della fosforilazione ossidativa e della fotofosforilazione.
Questi principi, condivisi da mitocondri, cloroplasti e procarioti, spiegano come il trasferimento di elettroni, orchestrato da proteine di membrana, sia convertito in lavoro chimico: la generazione controllata di un gradiente di protoni capace di alimentare processi essenziali quali la sintesi di ATP, il trasporto attivo di soluti e la regolazione del volume cellulare.
La quantità di energia liberata da un trasferimento di elettroni è determinabile dal confronto dei potenziali redox delle coppie coinvolte. Consideriamo il flusso di elettroni dal NADH all’O₂. La coppia NAD⁺/NADH presenta un potenziale redox standard di circa −320 mV, indicativo di una bassa affinità per gli elettroni e dunque di una spiccata tendenza a cederli; la coppia O₂/H₂O, al contrario, possiede un potenziale redox di circa +820 mV, segno di elevata capacità ossidante e forte propensione ad accettare elettroni. La differenza di potenziale tra i due stati redox è quindi \(\Delta E^\circ' \approx +1{,}14\ \text{V}\), che prefigura un trasferimento altamente favorito dal punto di vista termodinamico.
La relazione tra potenziale redox e energia libera standard è data da:
\[\Delta G^\circ' = -nF\,\Delta E^\circ'\]
dove \(n\) è il numero di elettroni trasferiti e \(F\) la costante di Faraday. Per la cessione di due elettroni da una mole di NADH all’ossigeno si ottiene \(\Delta G^\circ' \approx -2 \times 96\,485\ \text{C mol}^{-1} \times 1{,}14\ \text{V} \approx -220\ \text{kJ mol}^{-1}\), pari a circa −52,6 kcal/mol. Questo valore, per una singola mole di NADH, supera ampiamente l’energia libera di formazione di un legame fosfoanidridico in ATP: l’idrolisi standard dell’ATP libera circa 30,5 kJ/mol (7,3 kcal/mol), mentre nelle condizioni cellulari tipiche la differenza di energia libera effettiva può avvicinarsi a 50 kJ/mol (circa 12 kcal/mol). Ne consegue che l’energia resa disponibile dall’ossidazione di NADH da parte dell’O₂ è più che sufficiente per la sintesi di diverse molecole di ATP.
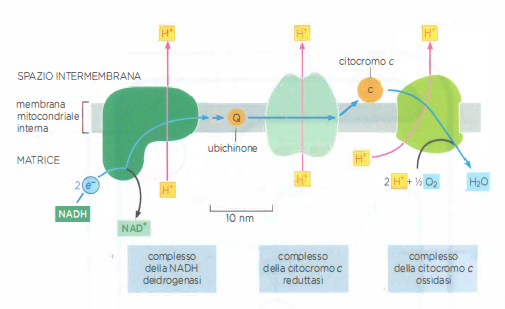
Nel mitocondrio, tuttavia, gli elettroni non transitano direttamente dal NADH all’ossigeno. La catena di trasporto mitocondriale convoglia il flusso elettronico attraverso una serie ordinata di intermedi, ciascuno con potenziale redox progressivamente crescente. Questa organizzazione evita il rilascio improvviso di calore e consente di immagazzinare una frazione sostanziale dell’energia libera sotto forma di forza proton-motrice attraverso la membrana interna, che alimenta la sintesi di ATP tramite la ATP sintasi, anziché dissiparsi nell’ambiente come calore.
I tre grandi complessi enzimatici della catena respiratoria contengono numerosi centri redox legati in modo stabile alle proteine. In questi centri, l’elettrone procede per “salti” tra siti metallici adiacenti con affinità crescente, seguendo il gradiente di potenziale redox. La coordinazione del metallo nel sito attivo, l’ambiente proteico e la distanza/geomentria tra i centri determinano la velocità e la direzionalità del trasferimento.
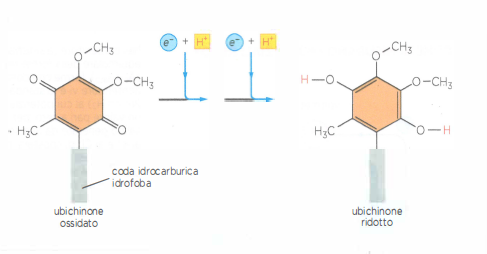
Il passaggio tra complessi adiacenti è affidato a trasportatori mobili che diffondono all’interno della membrana o nello spazio intermembrana, prelevando elettroni da un complesso e cedendoli al successivo con precisa specificità. Nella catena respiratoria mitocondriale, l’ubichinone (coenzima Q), molecola isoprenoide fortemente lipofila, riceve elettroni dal complesso della NADH deidrogenasi e li conferisce al complesso della citocromo c reduttasi (Figura 05.13-08). Un chinone con funzioni analoghe opera anche nella fotosintesi. L’ubichinone può accettare uno o due elettroni; la forma completamente ridotta, l’ubichinolo, incorpora in modo concertato due protoni provenienti dalla matrice, contribuendo al bilancio protonico della membrana (Figura 05.13-03). Il suo potenziale redox intorno a +30 mV lo colloca, in termini energetici, tra la NADH deidrogenasi e la citocromo c reduttasi, spiegando la direzione del trasferimento (Figura 05.13-04). Oltre che dal NADH attraverso il complesso I, l’ubichinone può ricevere elettroni direttamente dal FADH₂ generato nel ciclo dell’acido citrico e dall’ossidazione degli acidi grassi.
I potenziali redox dei cofattori metallici determinano la loro posizione funzionale nella catena:
- centri ferro-zolfo, con affinità relativamente bassa per gli elettroni, sono predominanti nelle prime tappe e trasferiscono elettroni all’ubichinone, come accade nel complesso della NADH deidrogenasi;
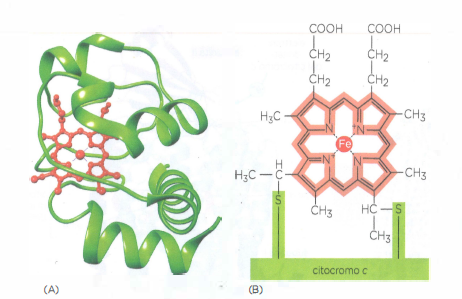
- gruppi eme dei citocromi, in cui il ferro transita reversibilmente tra Fe²⁺ e Fe³⁺, operano a potenziali progressivamente più elevati lungo la catena e conferiscono il caratteristico assorbimento ottico alle proteine citocromiche (citocromo c reduttasi e citocromo c ossidasi) (Figura 05.13-05);
- il citocromo c, piccola proteina periplasmatica dello spazio intermembrana, veicola elettroni tra il complesso della citocromo c reduttasi e quello della citocromo c ossidasi, con un potenziale redox di circa +230 mV, approssimativamente intermedio rispetto ai partner di interazione (Figura 05.13-04).
Come esempio numerico, il passaggio di un elettrone dal citocromo c (\(+230\ \text{mV}\)) all’ossigeno (\(+820\ \text{mV}\)) presenta \(\Delta E^\circ' \approx +0{,}59\ \text{V}\), corrispondenti a \(\Delta G^\circ' \approx -F\Delta E^\circ' \approx -57\ \text{kJ mol}^{-1}\) per elettrone, a testimonianza dell’elevata forza trainante anche nelle tappe terminali.
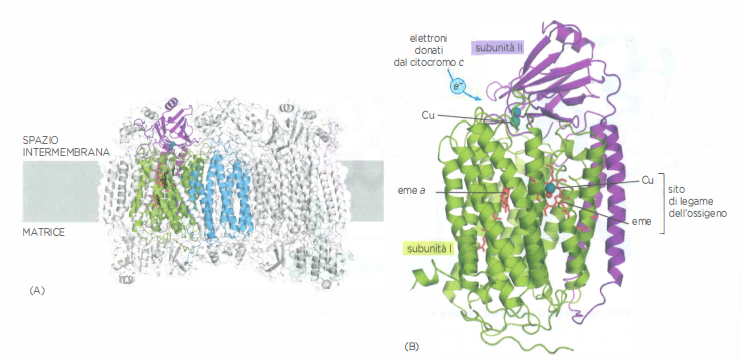
La citocromo c ossidasi, ultimo accettore della catena respiratoria, possiede il più alto potenziale redox tra i complessi mitocondriali. Questo complesso multiemetallico ossida il citocromo c, sottraendogli elettroni, e li convoglia verso l’ossigeno molecolare. L’alta affinità per gli elettroni dipende da un sito binucleare di legame dell’O₂, costituito da un gruppo eme e da un atomo di rame in stretta cooperazione strutturale (Figura 05.13-06). In tale sito viene consumata la quasi totalità dell’ossigeno inspirato: gli elettroni originariamente donati dal NADH percorrono la catena e si combinano con O₂ per formare H₂O.
La reazione globale catalizzata dal complesso è:
\[4\,e^- + 4\,H^+ + O_2 \rightarrow 2\,H_2O\]
Per ciascuna molecola di O₂ ridotta, oltre ai quattro protoni consumati per la formazione di acqua, la citocromo c ossidasi pompa attivamente altri quattro protoni dalla matrice nello spazio intermembrana durante il trasferimento di quattro elettroni dal citocromo c all’ossigeno. Il meccanismo comporta cambiamenti conformazionali allosterici che coordinano l’ingresso, l’instradamento e l’espulsione vettoriale dei protoni, contribuendo al gradiente elettrochimico transmembrana (Figura 05.13-07).
L’ossigeno è un accettore finale ideale per via della sua elevata affinità elettronica, ma la riduzione monoelettronica produce il radicale superossido, \(O_2^{\,-}\), specie altamente reattiva in grado di danneggiare DNA, proteine e lipidi di membrana. Un ruolo cruciale della citocromo c ossidasi è trattenere e attivare la molecola di O₂ nel sito binucleare fino all’arrivo sequenziale dei quattro elettroni necessari a completarne la riduzione a due molecole d’acqua, prevenendo il rilascio di intermedi reattivi dell’ossigeno. Sistemi enzimatici cellulari come superossido dismutasi e catalasi cooperano ulteriormente nel controllo delle specie reattive dell’ossigeno.
L’evoluzione di questo complesso è stata determinante per l’affermazione della respirazione aerobica. Inibitori ad alta affinità, come il cianuro, la azide o il monossido di carbonio, si legano ai centri metalloproteici della citocromo c ossidasi, bloccando il trasferimento di elettroni e arrestando la formazione di ATP, con esiti rapidamente letali per le cellule aerobie.